题目内容
物质结构理论有助于人们研究化学反应规律.请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途.
①铜原子价电子排布式为
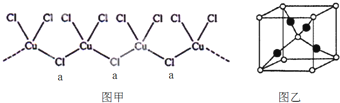
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 .该化合物阴离子的化学式为 ;
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 .
a.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子的键角小于H2O分子的键角
c.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如图乙所示.A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称).
(1)在第三周期中,第一电离能大于硫的元素有
(2)铜及其化合物在科学研究和工农业生产中有许多用途.
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为

③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
a.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子的键角小于H2O分子的键角
c.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如图乙所示.A的化学式为
考点:原子核外电子排布,配合物的成键情况,晶胞的计算,铜金属及其重要化合物的主要性质
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅤA族的第一电离能大于第ⅥA族元素,
(2)①铜是29号元素,根据核外电子排布规律书写;
②a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,据此判断;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,据此书写;
③根据的[Cu(NH3)4]SO4结构判断选项;
④根据反应生成砖红色沉淀物质为氧化亚铜;利用均摊法进行计算.
(2)①铜是29号元素,根据核外电子排布规律书写;
②a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,据此判断;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,据此书写;
③根据的[Cu(NH3)4]SO4结构判断选项;
④根据反应生成砖红色沉淀物质为氧化亚铜;利用均摊法进行计算.
解答:
解:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅤA族的第一电离能大于第ⅥA族元素,第一电离能大于硫的元素有P、Cl、Ar;
故答案为:3;
(2)①铜是29号元素,其基态原子的价电子排布式为:3d104s1,故答案为:3d104s1;
②a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为sp3,一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,阴离子为[CuCl3]2-,故答案为:sp3;[CuCl3]2-;
③a.NH3分子和H2O分子之间形成2种不同的氢键,故a错误;
b.氨气分子的键角为107.18′,水分子的键角为104.30′,NH3分子的键角大于H2O分子的键角,故b错误;
c.N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故c正确;
d.[Cu(NH3)4]SO4组成元素中电负性最大的是氧元素,故d错误;
故答案为:c;
④根据现象反应生成砖红色沉淀,该物质为氧化亚铜(Cu2O);由晶胞可知Cu原子位于晶胞内部,晶胞中的白点代表的原子有:含有4个Cu,Cl位于顶点和面心,共含有8×
×8+1=2,晶胞中的黑点代表的原子有4,据比例确定晶胞中的白点代表的原子为氧,
故答案为:Cu2O;氧.
故答案为:3;
(2)①铜是29号元素,其基态原子的价电子排布式为:3d104s1,故答案为:3d104s1;
②a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为sp3,一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,阴离子为[CuCl3]2-,故答案为:sp3;[CuCl3]2-;
③a.NH3分子和H2O分子之间形成2种不同的氢键,故a错误;
b.氨气分子的键角为107.18′,水分子的键角为104.30′,NH3分子的键角大于H2O分子的键角,故b错误;
c.N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故c正确;
d.[Cu(NH3)4]SO4组成元素中电负性最大的是氧元素,故d错误;
故答案为:c;
④根据现象反应生成砖红色沉淀,该物质为氧化亚铜(Cu2O);由晶胞可知Cu原子位于晶胞内部,晶胞中的白点代表的原子有:含有4个Cu,Cl位于顶点和面心,共含有8×
| 1 |
| 8 |
故答案为:Cu2O;氧.
点评:本题以铜元素及其化合物为载体,考查原子结构示意图、原子轨道杂化、化学式的书写等,题目难度较大.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol硫酸钾中阴离子所带电荷数为NA |
| B、标准状况下,NA个SO3分子所占的体积约为22.4L |
| C、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ |
| D、标准状况下,22.4LCl2与足量氢氧化钠溶液反应转移的电子数为NA |
“节能减排,保护环境”已经深入人心,下列举措与这一主题不吻合的是( )
| A、用“绿色化学”工艺,使原料完全转化为产物 |
| B、推广燃煤脱硫技术,防治SO2污染 |
| C、推广垃圾的分类存放、回收、处理 |
| D、大量使用农药化肥提高粮食产量 |
为了区别0.1mol/L的硫酸溶液和水,下列方案不合理的是( )
| A、将BaCl2溶液分别滴入两种液体中,变浑浊的是硫酸溶液 |
| B、将两种液体分别滴入碳酸氢钠粉末中,有气泡产生的是硫酸溶液 |
| C、将酚酞溶液分别滴入两种液体中,变红色的是硫酸溶液 |
| D、测试这两种液体的导电性,导电性强的是硫酸溶液 |
只用一种试剂可鉴别(NH4)2SO4、NH4Cl、AlCl3、Na2SO4和NaCl五种溶液,这种试剂是( )
| A、NaOH |
| B、HCl |
| C、Ba(OH)2 |
| D、H2SO4 |

