题目内容
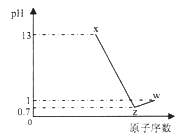
【题目】25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是( )
A.1×10-7mol·L-1 B.1×10-12mol·L-1
C.1×10-2mol·L-1 D.1×10-14mol·L-1
【答案】B
【解析】酸溶液中的氢氧根来自水的电离,分析水电离出的氢离子可计算溶液中的氢氧根,25℃时,pH=2的HCl溶液中,c(H+)=1×10-2 mol·L-1,c(OH-)= 1×10-12mol·L-1,由水电离出的H+浓度是1×10-12mol·L-1,选B。

练习册系列答案
相关题目
【题目】如表是元素周期表的前四周期:
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三 | G | H | I | |||||
四 | J |
回答下列问题:
(1)G元素与E元素形成含有非极性键的化合物的化学式是____,I与J的原子序数相差为_____.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是__(用化合物的化学式表示,下同),酸性最强的是_____,E、F、G三种元素形成的简单离子半径由大到小的顺序是_______(用离子符号回答).