题目内容
I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合, 则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________________________。
I.(1)吸热;D F;(2)A
II. (1)1×10-12 < 促进 (2)①Na2CO3溶液>NaCN溶液>CH3COONa溶液 ② >
③NaCN+H2O+CO2==HCN+NaHCO3
解析试题分析:对于①K1=C(CO)/C(CO2);对于②K2=C(H2)/C(H2O)。①--②得CO2(g) +H2(g)=CO(g)+H2O(g)当反应达到平衡时K="{" C(CO)·C(H2O)}/{ C(CO2) ·C(H2)} ="{" C(CO)/ C(CO2)} ·{ C(H2O) C(H2)}=K1/K2.在973K时K= K1/K2=1.47÷2.36;在1173K时,K= K1/K2=2.15÷1.67.可见升高温度,K增大,即升高温度化学平衡向正反应方向移动。根据平衡移动原理:升高温度平衡向吸热反应方向移动。正反应方向是吸热反应。所以△H >0。该反应是一个反应前后气体体积相等的吸热反应。改变压强或加入催化剂平衡都不能移动。升高温度。平衡正向移动,降低温度平衡向逆反应方向移动。减少CO的量,也就减少CO的浓度,平衡正向移动。所以使CO2(g) +H2(g)=CO(g)+H2O(g) △H >0向正反应方向移动的措施是D F。(2)升高温度,化学反应速率加快,增大反应物的浓度,化学反应速率加快,但温度的速率的影响要比浓度的速率的影响大。所以反应速率前者大。选项为A。II.在100度是KW=10-12.C(OH-)=1mol/L所以C(H+)= KW /C(OH-)=10-12mol/L.在25度时Kw=10-1410-12 =< KW。当向水中加入少量NH4HCO3固体时,由于,NH4+和氢氧根离子反应产生NH3·H2O;HCO3-和氢离子反应产生H2CO3。破坏了水的电离平衡,减小生成物的浓度,电离平衡向电离的方向移动,因而催进了水的电离。(2) ①根据电离常数可知酸性:CH3COOH>H2CO3>HCN> HCO3-。所以①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,都是强碱弱酸盐,水解显碱性。根据盐的水解规律:谁弱谁水解,谁强显谁性,越弱越水解。所以三种溶液的pH由大到小的顺序Na2CO3 >NaCN >CH3COONa。②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合,二者恰好反应产生CH3COO Na。该盐是强碱弱酸盐,CH3COO-水解消耗,所以混合溶液中c(Na+) >c(CH3COO-)。③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2==HCN+NaHCO3。
/考点:考查溶液的酸碱性、离子浓度的比较级外界条件对化学平衡、电离平衡等影响的知识。

把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2  2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
表二:N2+ 3H2
 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
A、N2+ O2
 2NO是吸热反应
2NO是吸热反应B、人类大规模模拟大气固氮是没有意义的
C、在常温下,增加工业固氮的容器的压强,K值会发生改变
D、工业固氮是放热反应
(2)向某密闭容器中加入4 mol NH3、1.2 mol H2和一定量的N2三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知0~t1阶段保持恒温、恒容,且c(N2)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件。

①若t1="15" s,则t0~t1阶段的反应速率为v(H2)=
②N2的起始物质的量为
③反应达到平衡状态,下列说法中能表明已达到平衡状态的是
A、单位时间内生成a molN2,同时生成3a mol H2 B、容器的总压强不再变化
C、混合气体的密度不再变化 D、三个H—H 键断裂的同时有六个H—N键断裂
④t4时刻改变的条件为 ,t5时刻改变的条件为
⑤已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________________
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变” 下同),H2O的体积分数
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是 (填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是 。
常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
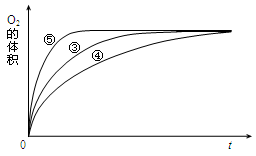
分析上图能够得出的实验结论是______________________________________。
 2NH3 (g) △H=" -" 92.4kJ/mol
2NH3 (g) △H=" -" 92.4kJ/mol 2NO2(g)△H<0体系中,各成分浓度随时间的变化如图:
2NO2(g)△H<0体系中,各成分浓度随时间的变化如图:
 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
 N2O4已经达到平衡。
N2O4已经达到平衡。
 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。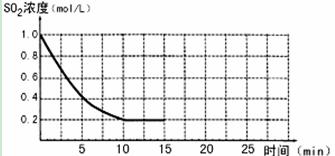
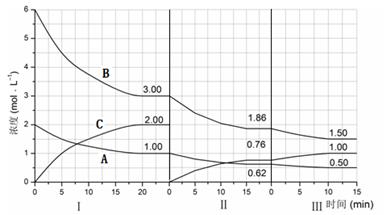
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: