题目内容
“元素的性质”中的“性质”的含义是什么?研究“元素性质的递变”,主要研究元素哪些方面的性质?
解析:
|
这里要研究的元素的性质,主要是指“元素原子得失电子的能力”.元素原子得失电子能力的强弱,可以通过许多方法间接说明.其中,元素原子失电子能力的强弱,可以从以下方面说明:①元素的单质与水或酸反应置换出氢的难易程度.越容易置换出氢,元素原子失电子能力越强;反之,越弱.②元素最高价氧化物对应的水化物的碱性强弱.碱性越强,元素原子失电子能力越强;反之,越弱.而元素原子得电子能力的强弱,可以从以下方面说明:①元素的单质与氢气化合生成气态氢化物的难易程度以及气态氢化物的稳定性.一般,单质与氢气化合越容易,氢化物越稳定,元素原子得电子能力就越强;反之,就越弱.②元素最高价氧化物对应的水化物的酸性强弱.一般来说,酸性越强,元素原子得电子能力越强;反之,越弱. |
提示:
|
研究元素性质的递变规律,必须先明确元素性质的具体表现方式,以便明确从哪个角度研究. |

 53天天练系列答案
53天天练系列答案A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23.(A)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有2对成对电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子![]() ,写出该微粒的电子式 (用元素符号表示)
,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同 b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
(B)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
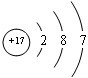
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物的水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下氯气的颜色比T单质的颜色深
b T的单质通入氯化钠水溶液不能置换出氯气
c 氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。


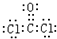
 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:

 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
