题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体.
(1)写出元素符号:A
(2)在由A、B、C、D四种元素两两组成的化合物中,其结构中存在非极性键的分子有
(3)写出两种均含有A、B、C、D四种元素的化合物两种:
(1)写出元素符号:A
H
H
,BO
O
,CNa
Na
,DS
S
.(2)在由A、B、C、D四种元素两两组成的化合物中,其结构中存在非极性键的分子有
H2O2
H2O2
;其结构中存在非极性键的离子化合物有Na2O2
Na2O2
;(各填写一种物质的化学式)(3)写出两种均含有A、B、C、D四种元素的化合物两种:
NaHSO3
NaHSO3
、NaHSO4
NaHSO4
.分析:根据元素在周期表中的位置,原子序数依次增大,确定它们的位置情况以及A、C两元素,利用B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍以来求B、D.
解答:解:根据四种短周期元素在周期表中的位置,原子序数依次增大,确定它们的位置为:A、C在一、三周期,B、D在在二、三周期,且A、C在B、D的左边,则A为A为氢、C为钠;利用B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,B为氧、D为硫,
(1)因A为氢、B为氧、C为钠、D为硫,所以元素符号分别为:H、O、Na、S,故答案为:H;O;Na;S;
(2)因H2O2中含有非极性键,Na2O2中存在非极性键,且为离子化合物,故答案为:H2O2;Na2O2;
(3)因H、O、Na、S四种元素形成的化合物有:NaHSO3、NaHSO4,故答案为:NaHSO3;NaHSO4.
(1)因A为氢、B为氧、C为钠、D为硫,所以元素符号分别为:H、O、Na、S,故答案为:H;O;Na;S;
(2)因H2O2中含有非极性键,Na2O2中存在非极性键,且为离子化合物,故答案为:H2O2;Na2O2;
(3)因H、O、Na、S四种元素形成的化合物有:NaHSO3、NaHSO4,故答案为:NaHSO3;NaHSO4.
点评:本题题较难,考查学生利用原子的结构来推断元素,注意本题中A、C与B、D可能存在情况来分析是解答本题的难点,然后结合元素化合物知识即可解答.

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为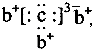 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为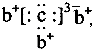 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
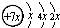 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
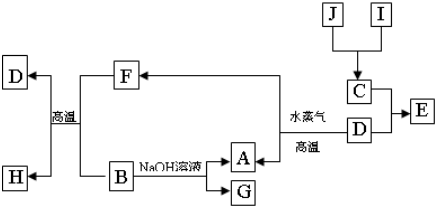
 Al(OH)3+OH-
Al(OH)3+OH-