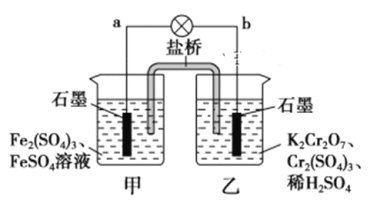
题目内容
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
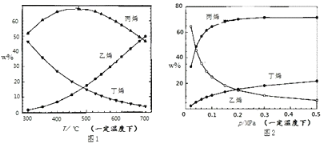
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
【答案】C4H8(g) + C2H4(g)== 2C3H6(g) ΔH= +148 kJ·mol1 a/(2V×t1)mol·L-1 ·min-1 D k 正/k 逆 C 450oC 比 300oC 的反应速率快;比 700oC 的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度 压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
【解析】
Ⅰ.(1)根据盖斯定律进行计算;
(2)根据速率的计算公式以及可逆反应达到平衡状态的标志进行判断;
(3)由Kp=p2(C3H6)/p(C4H8)p(C2H4)及v正=k正·p(C4H8)·p(C2H4),逆=k逆·p2(C3H6)得出结果;
Ⅱ.(1)根据图像1,在温度为300℃时丙烯的含量很高,乙烯的含量很小,即m(C3H6)/m(C2H4)的比值较大;根据图像2,压强在0.5MPa时丙烯的含量很高,乙烯的含量很小,即m(C3H6)/m(C2H4)的比值较大;
(2)450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度;
(3)由主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4可知,压强越大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
2C2H4可知,压强越大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
Ⅰ.(1)已知①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=-1411KJmol-1;②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H2=-2049KJmol-1;③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H3=-2539KJmol-1;根据盖斯定律将①+③-②×2可得C4H8(g)+C2H4(g)
O2(g)═3CO2(g)+3H2O(l)△H2=-2049KJmol-1;③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H3=-2539KJmol-1;根据盖斯定律将①+③-②×2可得C4H8(g)+C2H4(g)![]() 2C3H6(g) △H=(-1411)+(-2539)-(-2049)×2=+148kJ·mol1,故答案为:C4H8(g)+C2H4(g)=2C3H6(g) ΔH= +148kJ·mol1。
2C3H6(g) △H=(-1411)+(-2539)-(-2049)×2=+148kJ·mol1,故答案为:C4H8(g)+C2H4(g)=2C3H6(g) ΔH= +148kJ·mol1。
(2)① C4H8(g)+C2H4(g)=2C3H6(g)
平衡时物质的量 amol 2amol bmol
达到平衡状态,C3H6占平衡总体积的1/4,则b/a+2a+b=1/4,解得:a=b
该时间段内的反应速率v(C4H8)=1/2v(C3H6)=1/2Δc(C3H6)/Δt=1/2bmol/VL×t1min=b/(2V×t1)mol·L-1 ·min-1=a/(2V×t1)mol·L-1 ·min-1,故答案为:a/(2V×t1)mol·L-1 ·min-1。
②A.v(C4H8)生成、v(C3H6)消耗表示的都是逆反应速率,不能说明正逆反应速率相等,故A错误;
B.C4H8、C2H4、C3H6的物质的量之比等于系数比,不能说明达到平衡状态,故B错误;
C.混合气体的平均相对分子质量M=m/n,该反应是一个反应前后物质的量不变的反应,反应前后质量不变,故混合气体的平均相对分子质量始终改变,不能说明达到平衡状态,故C错误;
D.C4H8、C2H4、C3H6 的浓度均不再变化是平衡的特征,故D正确。
故答案为:D。
(3)由C4H8(g)+C2H4(g)![]() 2C3H6(g)可知,Kp=p2(C3H6
2C3H6(g)可知,Kp=p2(C3H6
Ⅱ.(1)根据图像1,在温度为300℃时丙烯的含量很高,乙烯的含量很小,即m(C3H6)/m(C2H4)的比值较大;根据图像2,压强在0.5MPa时丙烯的含量很高,乙烯的含量很小,即m(C3H6)/m(C2H4)的比值较大,因此最适宜的条件为:300oC、0.5MPa,故C正确,故答案为:C。
(2)450℃的反应温度比300℃或700℃更合适的可能的原因有:450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度,故答案为:450℃比300℃的反应速率快;比700℃的副反应程度小;丁烯转化成丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度。
(3)由主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4可知,压强越大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大,故答案为:生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
2C2H4可知,压强越大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大,故答案为:生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
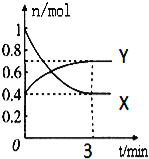
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.