题目内容
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为___________ .
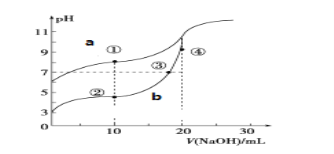
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.
NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为__________ .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:________________ .
【答案】BC 1.6×10﹣8(mol·L﹣1)3 0.05mol·L﹣1·min﹣1 25℃反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大
【解析】
(1)①根据化学平衡的标志来判断;
②先根据反应 NH2COONH4(s)2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2的平衡浓度,代入平衡常数的表达式计算;
(2)③根据化学反应速率的公式计算;
④由图象数据,用不同初始浓度,不同温度下的平均速率的大小说明.
(1)①A.未指明速率的方向,无法确定正逆反应速率的关系,不能确定反应是否达到平衡状态,故A错误;
B.该反应是气体体积增大的反应,当容器内压强不变时,气体的总量也不再发生变化,已达到平衡,故B正确;
C.容器的体积不变,该反应是气体质量增大的反应,当密闭容器中混合气体的密度不变,已达到平衡,故C正确;
D.因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为![]() ,不能判定反应是否达到平衡状态,故D错误;
,不能判定反应是否达到平衡状态,故D错误;
故答案为:BC;
②25.0℃时,平衡气体总浓度4.8×10-3mol·L-1,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3mol·L-1、1.6×10-3mol·L-1,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3=1.6×10-8,故答案为:1.6×10-8;
(2)③25℃时,0~6min氨基甲酸铵水解反应的平均速率为V=![]() =
=![]() =0.05mol·L﹣1·min﹣1,故答案为:0.05mol·L﹣1·min﹣1;
=0.05mol·L﹣1·min﹣1,故答案为:0.05mol·L﹣1·min﹣1;
④25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,说明水解反应的平均速率随温度升高而增大。
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D