题目内容
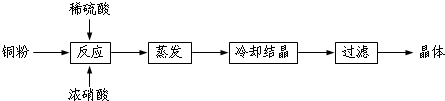
3.NH2经一系列反应可以得到NNO3和NH4NO2,如同1所示.
(1)在恒容密闭容器中通入NO2并发生反应2NO2(g)?N2O4(g).温度T1、T2下,NO2的物质的量浓度c(NO2)随时间变化的曲线如图2所示
①T2下,在0-t1min内,v(N2O4)═$\frac{a-b}{2{t}_{1}}$mol/(L•min)
②M点的正反应速率v正大于N点的逆反应速率v逆(填“大于”“小于”或“等于”)
③M点时,在加入一个定量NO2,平衡后NO2的转化率变大(填“大于”“小于”或“等于”)
(2)Ⅲ中,将NO2(g)转化为N2O4(l),在制备浓硝酸.N2O4与O2、H2O化合的化学方程式是2N2O4+O2+2H2O=4HNO3(填一个)
(3)Ⅳ中,电解NO制备NH4NO2,其工作原理如图3所示,为使电解产物全部转化为NH4NO2,需补充物质A,A是NH3,说明理由:根据得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,所以需补充NH3.
分析 (1)①根据v=$\frac{△c}{△t}$计算反应速率,在0-t1min内,NO2的物质的量浓度变化了(a-b)mol/L,2NO2(g)?N2O4(g),则N2O4的物质的量浓度变化了$\frac{a-b}{2}$mol/L;
②温度越高,反应速率越大,温度T1先到达平衡点,温度T1>T2,根据在温度T1、T2下,M点表示平衡状态v正=v逆,N点表示未达平衡状态,平衡正向进行v正>v逆分析;
③在恒容密闭容器中,M点表示平衡状态,再加入一个定量NO2,2NO2(g)?N2O4(g),平衡向正反应方向进行,平衡后NO2的转化率变大;
(2)N2O4与O2、H2O化合生成硝酸,根据得失电子守恒和原子守恒写出反应的方程式;
(3)根据电解NO制备NH4NO3的反应方程式分析判断,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O;
解答 解:(1)①由图可知,T2下,在0-t1min内,NO2的物质的量浓度变化了(a-b)mol/L,则N2O4的物质的量浓度变化了$\frac{a-b}{2}$mol/L,故化学反应速率v(N2O4)=$\frac{△c}{△t}$=$\frac{a-b}{2{t}_{1}}$mol/(L•min),
故答案为:$\frac{a-b}{2{t}_{1}}$mol/(L•min);
②由图可知,温度T1先到达平衡点(先出现拐点),温度T1>T2,所以在温度T1、T2下,到达平衡时v1正>v2正,在温度T1下,M点表示平衡状态v1正=v1逆,N点表示未达平衡状态,平衡正向进行v2正>v2逆,所以M点的正反应速率v正大于N点的逆反应速率v逆,
故答案为:大于;
③在恒容密闭容器中,增大压强,平衡向体积缩小的方向移动,M点表示平衡状态,再加入一个定量NO2,既增大了反应物的浓度,又增大了压强,平衡正向移动,相对原平衡二氧化氮转化率增大,
故答案为:变大;
(2)N2O4与O2、H2O化合生成硝酸,其反应的化学方程式为:2N2O4+O2+2H2O=4HNO3,
故答案为:2N2O4+O2+2H2O=4HNO3;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
故答案为:NH3;根据得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,所以需补充NH3.
点评 本题考查了化学反应速率的计算、影响平衡的因素、化学方程式书写、电解的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握.

 名校课堂系列答案
名校课堂系列答案(1)溴的基态原子的价电子排布图为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘(I).
| 元素名称 | 氟 | 氧 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
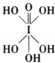 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为2,孤电子对对数为3.
(6)写出一个CO2的等电子体:CS2、N2O.
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 无法确定是否有③ | D. | 至少存在①、④、⑤ |
| A. | 温度升高,c(H2PO4-)增大 | |
| B. | 加水稀释后,m(H+)与m(OH-)的乘积减少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
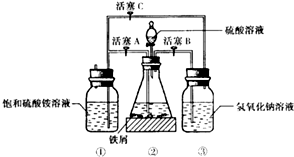
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABCD(填序号).
A.Fe+2H+═Fe2++H2↑
B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓
D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1•L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.
滴定时,将KMnO4溶液装在酸式(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
| A. | 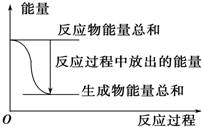 反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
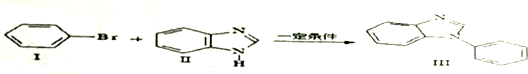
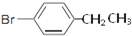 、
、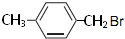 .
.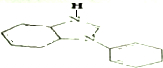 .
.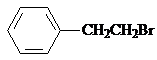 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为: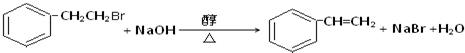 .
.