题目内容
下列化学用语正确的是( )
A、乙醇分子的结构式: |
B、氯原子的结构示意图: |
C、过氧化氢分子的电子式: |
| D、硫酸钠的电离方程式:Na2SO4=Na2++SO42- |
考点:电子式、化学式或化学符号及名称的综合,原子结构示意图,电离方程式的书写
专题:
分析:A.用短线表示所有共用电子对即为结构式;
B.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
C.过氧化氢属于共价化合物,分子中不存在阴阳离子;
D.硫酸钠电离出钠离子和硫酸根离子,钠离子带有1个正电荷.
B.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
C.过氧化氢属于共价化合物,分子中不存在阴阳离子;
D.硫酸钠电离出钠离子和硫酸根离子,钠离子带有1个正电荷.
解答:
解:A.乙醇分子中含有1个甲基、1个亚甲基和1个羟基,乙醇的结构式为: ,故A正确;
,故A正确;
B.氯原子的核电荷数、核外电子总数都是17,最外层为7个电子,氯原子结构示意图为: ,故B错误;
,故B错误;
C.过氧化氢为共价化合物,分子中存在两个氧氢键和1个氧氧单键,过氧化氢的电子式为: ,故C错误;
,故C错误;
D.硫酸钠电离出钠离子和硫酸根离子,硫酸钠的电离方程式为:Na2SO4=2Na++SO42-,故D错误;
故选A.
 ,故A正确;
,故A正确;B.氯原子的核电荷数、核外电子总数都是17,最外层为7个电子,氯原子结构示意图为:
 ,故B错误;
,故B错误;C.过氧化氢为共价化合物,分子中存在两个氧氢键和1个氧氧单键,过氧化氢的电子式为:
 ,故C错误;
,故C错误;D.硫酸钠电离出钠离子和硫酸根离子,硫酸钠的电离方程式为:Na2SO4=2Na++SO42-,故D错误;
故选A.
点评:本题考查了结构式、原子结构示意图、电子式、电离方程式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确过氧化氢与过氧化钠、羟基与氢氧根离子的电子式的区别.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
氮化铝(AlN)是一种新型陶瓷材料.可通过如下反应制备:Al2O3+N2+3C
2AlN+3CO.关于该反应的说法正确的是( )
| ||
| A、该反应是复分解反应 |
| B、Al2O3 是氧化剂 |
| C、N2发生还原反应 |
| D、每反应1molN2转移3mol电子 |
大功率的镍氢电池使用在油电混合动力车辆中.镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的是( )


| A、放电时电池内部H+向负极移动 |
| B、充电时,将电池的负极与外接电源的正极相连 |
| C、充电时阳极反应为Ni(OH)2+OH--e-═NiOOH+H2O |
| D、放电时负极的电极反应式为MHn-ne-=M+nH+ |
下列化学用语或模型表达正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、H2O的电子式: | ||
C、Cl-的结构示意图: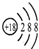 | ||
D、CH4分子的比例模型: |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L CCl4含有C-Cl键的数目为4NA |
| B、取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35NA |
| C、反应NH4N3?2N2↑+2H2↑,标准状况下每生成22.4L N2,转移电子的数目为2NA |
| D、电解精炼铜时,若转移的电子数为NA个,则阳极质量减少32g |

 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和

