题目内容
4.在一定条件下可实现如图所示物质之间的转化: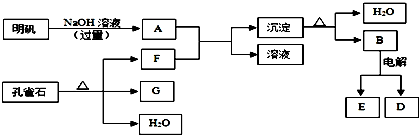
请填写下列空白:
(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是CO2(填化学式).
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:Al3++4OH-=AlO2-+2H2O.
(3)写出B电解生成E和D的反应方程式:2 Al2O3$\frac{\underline{\;电解\;}}{\;}$4 Al+3 O2↑.
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3,该反应消耗了2molC,则转移的电子数是2.408х1024.
分析 孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物,则B为氧化铝,电解熔融氧化铝生成铝和氧气,据此解答.
解答 解:孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物,则B为氧化铝,电解熔融氧化铝生成铝和氧气,
(1)由上述分析可知F为CO2,故答案为:CO2;
(2)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(3)B电解生成E和D的反应方程式:2 Al2O3$\frac{\underline{\;电解\;}}{\;}$4 Al+3 O2↑,
故答案为:2 Al2O3$\frac{\underline{\;电解\;}}{\;}$4 Al+3 O2↑;
(4)G为氧化铜,若D为固体,则D为Al,铝和氧化铜高温下的发生铝热反应,该反应化学方程式为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3,该反应消耗了2mol CuO,则转移的电子为2mol×2×6.02х1023mol-1=2.408х1024,
故答案为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3;2.408х1024.
点评 本题为框图式物质推断题,难度不大,根据碱式碳酸铜分解反应与明矾与是氢氧化钠反应反应产物进行推断,掌握物质的性质是关键.

| 族 | LA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)下列事实能证明②的非金属性比⑥强的是CD
A:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
B:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
C:Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3;
D:CH4比SiH4稳定
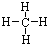
(3)写出①、③、④三种元素组成化合物的电子式

(4)③、④、⑤的形式的简单离子半径依次减小(填“增大”、“减小”或“不变”)
(5)①、②、⑦三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
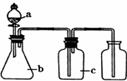 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
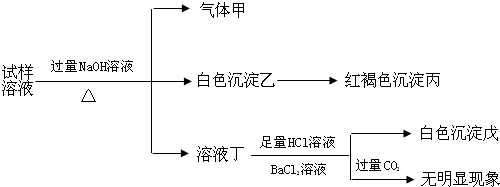
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
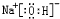 、
、 .
.