题目内容
16.常温下,关于pH=5的NaHSO3和pH=9的NaHCO3两种溶液,下列说法正确的是( )| A. | 两溶液中由水电离产生的c(H+)相等 | |
| B. | 两溶液中均存在c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)(R代表C、S) | |
| C. | 向NaHSO3溶液中滴加次氯酸钠溶液,c(HSO3-)增大 | |
| D. | 两溶液中均存在:c(OH-)+2c(RO32-)+c(HRO3-)=c(H+)+c(Na+)(R代表C、S) |
分析 A.亚硫酸氢钠溶液呈酸性,溶液中氢离子抑制了水的电离;碳酸氢钠溶液呈碱性,碳酸氢根离子水解促进了水的电离;
B.碳酸氢钠溶液呈碱性,则c(H+)<c(OH-),NaHSO3呈酸性,则c(H+)>c(OH-);
C.次氯酸根离子能够将亚硫酸氢根离子氧化成硫酸根离子,导致硫酸氢根离子浓度减小;
D.根据两溶液中的电荷守恒判断.
解答 解:A.pH=5的NaHSO3和pH=9的NaHCO3两种溶液中,前者亚硫酸氢根离子的电离程度大于其水解程度,溶液呈酸性,抑制了水的电离;后者碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,促进了水的电离,两溶液中液中水电离的氢离子浓度不相等,故A错误;
B.NaHSO3溶液呈酸性,则c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-),NaHCO3溶液呈碱性,则c(Na+)>c(HRO3-)>c(OH-)>c(H+)>c(RO32-),故B错误;
C.向NaHSO3溶液中滴加次氯酸钠溶液,亚硫酸氢根离子被氧化成硫酸根离子,导致c(HSO3-)减小,故C错误;
D.根据电荷守恒可知两溶液中均存在:c(OH-)+2c(RO32-)+c(HRO3-)=c(H+)+c(Na+)(R代表C、S),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列反应既属于氧化还原反应又属于放热反应的是( )
| A. | CH3COOH溶液与NaOH溶液混合 | B. | Al与Fe2O3高温下的铝热反应 | ||
| C. | KMnO4分解制氧气 | D. | Na2CO3在溶液中的水解 |
7.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | ||
| C. | C D.D |
4.下列叙述错误的是( )
| A. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| B. | 过氧化钠可用于呼吸面具作为氧气的来源 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 合金的硬度一般比它的各成分金属的大,熔点一般比它的各成分金属的高 |
11.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 含18O的乙醇和乙酸反应制备乙酸乙酯则反应后18O存在于任何物质中 | 对,因为此反应为可逆反应 |
| B | 往苯酚钠溶液中通入CO2,可制备得到苯酚,并得到碳酸氢钠 | 对,根据强酸制弱酸的规律,碳酸的酸性比苯酚的酸性强,故可用此反应制备苯酚 |
| C | 向卤代烃水解后的溶液中直接加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀 |
| D | 用酸性高锰酸钾溶液除去甲烷中的乙烯气体 | 对,乙烯能与酸性高锰酸钾溶液反应,而甲烷不能与高锰酸钾溶液反应. |
| A. | A | B. | B | C. | C | D. | D |
1.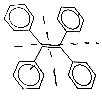 某有机物结构简式如图所示.下列说法不正确的是 ( )
某有机物结构简式如图所示.下列说法不正确的是 ( )
 某有机物结构简式如图所示.下列说法不正确的是 ( )
某有机物结构简式如图所示.下列说法不正确的是 ( )| A. | 该有机物的分子式为C26H20 | |
| B. | 该有机物不能使溴水褪色 | |
| C. | 该有机物的一氯代物有3种 | |
| D. | 该有机物既可发生加成反应,又可发生取代反应 |
8.下列各反应中,能说明浓H2SO4既有氧化性又有酸性的是( )
| A. | S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O | |
| B. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | |
| C. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O | |
| D. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
5.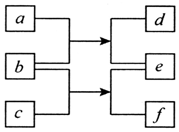 短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )| A. | 原子半径的大小W<Y<Z | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氧化物一定为酸性氧化物 | D. | Z的含氧酸一定为强酸 |
9.下列说法正确的是( )
| A. | 高锰酸钾在常用危险化学品分类中属于第4类易燃固体 | |
| B. | 浓氢氧化钠溅到皮肤上,立即用大量水冲洗,再涂上稀硼酸溶液 | |
| C. | 做蒸发结晶实验时,用坩埚钳夹持热蒸发皿直接放于实验台面上 | |
| D. | 做分液操作时,待液体分层将上层液体从上口倒出后,下层液体从下口放出 |