题目内容
1.某溶液中可能含有Na+、NH4+、Ba2+、Br-、CO32-、I-、SO32-.某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化.下列说法正确的是( )| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
分析 取样,滴加足量氯水,有气泡产生,含有CO32-,溶液呈橙色,含有Br-;因CO32-与Ba2+反应,则一定没有Ba2+;向橙色溶液中加BaCl2溶液或淀粉均无现象,则一定没有I-,且SO32-能被氯水氧化生成硫酸根离子会与氯化钡反应生成白色沉淀,则一定没有SO32-;显然不能确定Na+、NH4+,以此来解答.
解答 解:在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,依据离子共存分析溶液中不可能存在Ba2+,溶液呈橙色,说明可能生成I2或Br2;
SO32-能被氯水氧化生成硫酸根离子会与氯化钡反应生成白色沉淀,向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.一定存在Br-;
所以溶液中一定不存在I-、SO32-,Ba2+;
一定存在Br-、CO32-,
由于没有涉及到Na+、NH4+离子的性质,但两者必有其中一种阳离子,Na+、用焰色反应,需要进一步实验验证铵根离子的存在,方法为:取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体;
故选D.
点评 本题考查离子的检验,注意离子之间的反应及常见离子的特征反应是解答本题的关键,明确还需检验铵根离子即可解答,题目难度不大.

练习册系列答案
相关题目
11.电解CuSO4溶液时,若要达到以下三个要求:①阳极质量减少;②阴极质量增加; ③电解溶液中c(Cu2+)不变,则可选用的电极是( )
| A. | 纯铜作阳极,含Zn、Ag的Cu合金作阴极 | |
| B. | 含Zn、Ag的Cu合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阳极,用惰性电极(Pt)作阴极 |
16.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
6.下列关于有机化合物的说法正确的是( )
| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
13.已知奥运会吉祥物的内充物为涤纶(结构简式为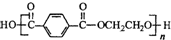 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )
 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
8.碳和氮的许多化合物在工农业生产和生活中有重要的作用.
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
①0~10min内,NO的平均反应速率v(NO)=0.042mol•L-1•min-1,T1℃时,该反应的平衡常数K=$\frac{9}{16}$;
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
 羧酸②
羧酸② 酚③
酚③ 芳香烃④
芳香烃④ 羧酸⑤
羧酸⑤ 酯.
酯.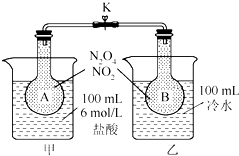 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.