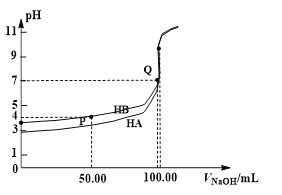
题目内容
【题目】下列指定反应的离子方程式正确的是
A. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
B. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
【答案】B
【解析】
A、电子得失不守恒;B、CaSO4固体和CaCO3固体转化;C、碱性溶液,不是酸性溶液;D、电解饱和食盐水生成氢氧化钠、氢气和氯气;
A、酸化NaIO3和NaI的混合溶液:5I +IO3+6H+![]() 3I2+3H2O,故A错误;B、CaSO4固体和CaCO3固体转化平衡:CO32+CaSO4
3I2+3H2O,故A错误;B、CaSO4固体和CaCO3固体转化平衡:CO32+CaSO4![]() CaCO3+SO42,故B正确;C、碱性溶液,不是酸性溶液,4OH-+3ClO+2Fe(OH)3
CaCO3+SO42,故B正确;C、碱性溶液,不是酸性溶液,4OH-+3ClO+2Fe(OH)3![]() 2FeO42+3Cl+5H2O,故C错误;D、电解饱和食盐水生成氢氧化钠、氢气和氯气:2Cl+2H2O
2FeO42+3Cl+5H2O,故C错误;D、电解饱和食盐水生成氢氧化钠、氢气和氯气:2Cl+2H2O![]() Cl2↑+ H2↑+2OH-,故D错误;故选B。
Cl2↑+ H2↑+2OH-,故D错误;故选B。

【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
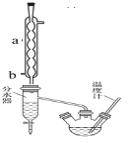
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。