题目内容
16. 某同学研究铝及其化合物的性质时设计了如下两个实验方案:
某同学研究铝及其化合物的性质时设计了如下两个实验方案:方案①:2.7g Al$\stackrel{100ml盐酸}{→}$X溶液$\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案②:2.7g Al$\stackrel{100mlNaOH溶液}{→}$Y溶液$\stackrel{盐酸}{→}$Al(OH)3沉淀
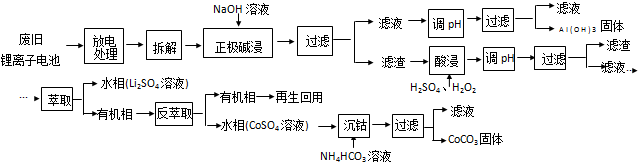
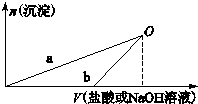
NaOH溶液和盐酸的浓度均是3mol•L-1,如图所示,向X溶液和Y溶液中分别加入NaOH溶液和盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | a、b曲线表示的反应都是非氧化还原反应 | |
| D. | X溶液显酸性,Y溶液显碱性 |
分析 n(HCl)=3mol/L×0.1L=0.3mol,n(NaOH)=3mol/L×0.1L=0.3mol,n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,2Al++6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,根据方程式知,Al和HCl完全反应需要n(HCl)=3n(Al)=0.3mol,所以Al和HCl恰好完全反应生成氯化铝;根据方程式知,Al和NaOH完全反应需要n(NaOH)=n(Al)=0.1mol<0.3mol,所以NaOH有剩余,据此分析解答.
解答 解:n(HCl)=3mol/L×0.1L=0.3mol,n(NaOH)=3mol/L×0.1L=0.3mol,n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,2Al++6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,根据方程式知,Al和HCl完全反应需要n(HCl)=3n(Al)=0.3mol,所以Al和HCl恰好完全反应生成氯化铝;根据方程式知,Al和NaOH完全反应需要n(NaOH)=n(Al)=0.1mol<0.3mol,所以NaOH有剩余,
A.加入溶液后先没有生成沉淀,则溶液中还发生其它反应,则该溶液应该是Y溶液,先发生酸碱中和反应,所以b曲线表示的是向Y溶液中加入HCl溶液,故A错误;
B.在O点时沉淀的物质的量相等,溶液中的溶质都是NaCl,根据最初的钠原子和Cl原子守恒知,两方案中所得溶液浓度相等,故C正确;
C.a、b曲线中没有电子转移,不属于氧化还原反应,故C正确;
D.根据以上分析知,X溶液中溶质是AlCl3,水解溶液呈酸性,Y溶液溶质为NaAlO2、NaOH,溶液显碱性,故D正确;
故选A.
点评 本题考查性质实验方案设计,为高考高频点,明确各个线段发生的化学反应是解本题关键,侧重考查学生分析问题、解答问题能力,题目难度中等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 只含有一种元素的物质 | B. | 漂粉精 | ||
| C. | 只含有一种分子式的物质 | D. | 胆矾 |
| A. | Br2、CO2、H2O、HBr | B. | CO2、O2、H2S、HCl | ||
| C. | Na2O2、S8、CO2、H2O | D. | CO2、H2S、H2O、HI |
| A. | 2Cl--2e-=Cl2↑ | B. | Cu2++2e-=Cu | ||
| C. | 4OH--4e-=2H2O+O2↑ | D. | 2H++2e-=H2↑ |
| A. | D C A B | B. | A D C B | C. | B A D C | D. | A D B C |
 .
.