题目内容
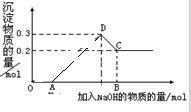
在盐酸酸化MgCl2和AlCl3的混和溶液中,逐滴加入1mol?L-1NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示,则:下列结果错误的是
- A.图中C点铝元素存在形式是[Al(OH)4]-
- B.n(Al3+)=0.01mol
- C.原混合液中c(MgCl2):c(AlCl3)=5:1
- D.OA段反应为:H++OH-=H2O
BC
分析:酸和碱的中和反应是优先的,然后氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,根据n(MgCl2)=n(Mg(OH)2],n(Al3+)=n(NaAlO2)=n(Al(OH)3)结合原子守恒知识来回答判断即可.
解答:A、CD段是氢氧化铝和氢氧化钠反应而溶解生成四羟基合铝酸钠的过程,即C点铝元素存在形式是[Al(OH)4]-,故A正确;
B、CD段是氢氧化铝和氢氧化钠反应而溶解生成四羟基合铝酸钠的过程,则n(Al3+)=n(NaAlO2)=n[Al(OH)3]=0.1mol,故B错误;
C、根据n(Al3+)=n[Al(OH)3]=0.1mol,AD段的沉淀是氢氧化镁和氢氧化铝的混合物,所以n(MgCl2)=n(Mg(OH)2]=0.2mol,原混合液中c(MgCl2):c(AlCl3)=2:1,故C错误;
D、根据提示信息可以知道,OA段是氢氧化钠和盐酸发生反应,实质为:H++OH-=H2O,故D正确.
故选BC.
点评:本题考查化学反应与图象,理清反应的整个过程,问题即可解决,即可利用方程式也可根据关系式,本题采取原子守恒计算.
分析:酸和碱的中和反应是优先的,然后氯化镁和氯化铝均可以和氢氧化钠发生反应,生成沉淀氢氧化镁和氢氧化铝,氢氧化铝能和氢氧化钠继续反应,直至氢氧化铝全部被消耗,根据n(MgCl2)=n(Mg(OH)2],n(Al3+)=n(NaAlO2)=n(Al(OH)3)结合原子守恒知识来回答判断即可.
解答:A、CD段是氢氧化铝和氢氧化钠反应而溶解生成四羟基合铝酸钠的过程,即C点铝元素存在形式是[Al(OH)4]-,故A正确;
B、CD段是氢氧化铝和氢氧化钠反应而溶解生成四羟基合铝酸钠的过程,则n(Al3+)=n(NaAlO2)=n[Al(OH)3]=0.1mol,故B错误;
C、根据n(Al3+)=n[Al(OH)3]=0.1mol,AD段的沉淀是氢氧化镁和氢氧化铝的混合物,所以n(MgCl2)=n(Mg(OH)2]=0.2mol,原混合液中c(MgCl2):c(AlCl3)=2:1,故C错误;
D、根据提示信息可以知道,OA段是氢氧化钠和盐酸发生反应,实质为:H++OH-=H2O,故D正确.
故选BC.
点评:本题考查化学反应与图象,理清反应的整个过程,问题即可解决,即可利用方程式也可根据关系式,本题采取原子守恒计算.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
下列实验操作、现象或反应原理的解释、结论均正确的一组是( )
| 操作、现象 | 解释或结论 |
| A.铝箔在酒精灯火焰上加热,熔化但不滴落 | 铝箔对熔化的铝有吸附作用 |
| B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 | 增大反应物的浓度,化学平衡向正反应方向移动 |
| C.证明Mg(OH)2沉淀可以转化为Fe(OH)3 沉淀 |
向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| A、铝箔在酒精灯火焰上加热,熔化但不滴落 |
| B、向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 |
| C、证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| D、取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 |