题目内容
在加热时,浓硫酸与铜发生反应的化学方程式为:2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
| A.是氧化还原反应 | B.浓硫酸是还原剂 |
| C.H2SO4表现了氧化性和酸性 | D.反应中Cu发生了氧化反应 |
B
解析试题分析:A、该反应中铜、硫元素的化合价发生了变化,是氧化还原反应,正确;B、硫元素的化合价降低被还原,作氧化剂,错误;C、硫酸作氧化剂,表现氧化性,同时有硫酸铜和水生成又表现了酸性,正确;D、铜的化合价升高,被氧化,正确,答案选B。
考点:考查对氧化还原反应的特征、氧化剂、还原剂、氧化反应的判断

练习册系列答案
相关题目
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是: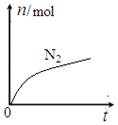
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.整个过程发生了复分解反应和氧化还原反应 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是
| A.苦卤中加入石灰乳MgCl2+ Ca(OH)2 = CaCl2 +Mg(OH)2 |
| B.苦卤中通入氯气2Br- + Cl2 = 2Cl- + Br2 |
C.氯碱工业电解食盐水2NaCl + 2H2O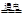 2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑ |
D.电解氯化镁MgCl2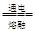 Mg + Cl2↑ Mg + Cl2↑ |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红色变为蓝绿色(反应如下),用此反应可测得司机是否是酒后驾车。此反应的氧化剂是( )
2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O
| A.H2SO4 | B.CrO3 | C.Cr2(SO4)3 | D.C2H5OH |
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
| A.Na2O2在上述反应中只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水 |
| D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
 mol
mol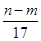 mol
mol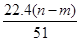 L
L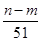 +
+ aTiCl4+cCO反应(1)
aTiCl4+cCO反应(1)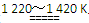 Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)