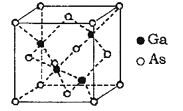
��Ŀ����
����Ŀ��ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��(CH3)2NNH2(l)+2N2O4(l)= 2CO2(g)+3N2(g)+4H2O(g) (��)
(1)��Ӧ(��)����������___________��
(2)����к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4(g)2NO2(g) (��)���¶�����ʱ��������ɫ�����Ӧ(��)Ϊ______(��������������������)��Ӧ��
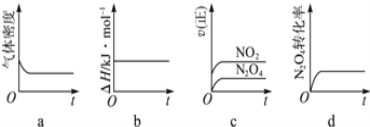
(3)һ���¶��£���Ӧ(��)���ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����_________��������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��______(������������������������С��)��
(4)NO2���ð�ˮ��������NH4NO3 ��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ����______________(�����ӷ���ʽ��ʾ)�������Һ�μ�b L ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫________(��������������������������)�ƶ������μӰ�ˮ��Ũ��Ϊ_______molL��1 ��(NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5molL��1)
���𰸡�N2O4 ���� ad ���� NH4++H2ONH3H2O+H+ ���� a/200b
��������
��1�����ݻ��ϼ۵ı仯���������ϼ۽��͵�������������ԭ��
��2�����¶�����ʱ��������ɫ���˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
��3����ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�
��4������笠�����ˮ������ش�����ͬ����ЧӦ��һˮ�ϰ���笠�����ˮ�����������ã�����һˮ�ϰ��ĵ���ƽ�ⳣ������õ���ˮŨ�ȣ�
����1����Ӧ�������У�N2O4��l����NԪ�صõ��ӻ��ϼ۽��ͣ�N2O4��l��������������CH3��2NNH2��l����CԪ�غ�NԪ�ػ��ϼ����ߣ��ǻ�ԭ����
�ʴ�Ϊ��N2O4��
��2��N2O4��g��2NO2��g�� �����������¶�����ʱ��������ɫ���˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��һ���¶��£���Ӧ���������ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�
a���ܶȵ����������������ƽ����ϵ�������䣬��Ӧ��������ܶ��ڷ�Ӧ�����м�С���ܶȲ���˵����Ӧ�ﵽƽ�⣬��a���ϣ�
b����Ӧ���ʱ�ͷ�Ӧ���������������ܺ�֮����㣬��ƽ���أ���b�����ϣ�
c��ͼ��ֻ��ʾ����Ӧ���ʱ仯������֤�����淴Ӧ������ͬ����c�����ϣ�
d��N2O4��l��ת���ʲ��䣬֤����Ӧ�ﵽƽ�⣬��d���ϣ�
ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����ad����ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����ƽ�ⳣ��K���䣻
�ʴ�Ϊ��ad�����䣻
NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�����Ϊ笠�����ˮ�⣻��Ӧ�����ӷ���ʽΪ��NH4++H2ONH3H2O+H+�����백ˮ��Һ����笠�����ˮ�⣬ƽ��������У���a mol NH4NO3����ˮ�������Һ�μ�b L ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10-7mol/L��c��NH4+��=c��NO3-����NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5 molL-1�����Ϻ���Һ���Ϊ1L��c��NH4+��=c��NO3-��=amol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH-��ƽ�ⳣ��K= ==2��10-5 molL-1������õ�c��NH3H2O��= a/200bmol/L��
==2��10-5 molL-1������õ�c��NH3H2O��= a/200bmol/L��
�ʴ�Ϊ��NH4++H2ONH3H2O+H+������a/200b��

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�