题目内容
【题目】香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2 , X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法正确的是( )
A.气态氢化物的沸点:W<T<R
B.离子半径:T﹣>R2﹣
C.最高价氧化物对应的水化物碱性:Y>X
D.XR2、WR2两化合物含有的化学键的类型相同
【答案】A
【解析】解:香花石化学式为X3Y2(ZWR4)3T2 , 由前20号元素中的6种组成,其中R原子最外层电子数为次外层电子数的3倍,R原子只能有2个电子层,最外层电子数为6,则R为O元素;Y、Z、R、T位于同周期,即处于第二周期,T元素无正价,则T为F元素;Z的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;X、Z位于同主族,则X为Mg元素或Ca元素,若X为镁元素,则由X与R原子序数之和是W的2倍,则 ![]() =10,推出W为氖元素不符合题意,若X为Ca元素,则由X与R原子序数之和是W的2倍,则
=10,推出W为氖元素不符合题意,若X为Ca元素,则由X与R原子序数之和是W的2倍,则 ![]() =14,推出W为Si元素,符合题意. A.常温下水为液态,HF、SiH4为气态,故水的沸点最高,HF分子之间形成氢键,沸点高于SiH4的,故A正确;
=14,推出W为Si元素,符合题意. A.常温下水为液态,HF、SiH4为气态,故水的沸点最高,HF分子之间形成氢键,沸点高于SiH4的,故A正确;
B.F﹣、O2﹣电子层结构相同,核电荷数越大离子半径越小,故离子半径F﹣<O2﹣ , 故B错误;
C.X为钙元素、Y为Li元素,金属性Ca>Li,则最高价氧化物对应的水化物碱性:氢氧化钙>氢氧化锂,故C错误;
D.XR2、WR2两化合物CaO2、SiO2 , CaO2含有离子键、共价键,SiO2中只含有共价键,故D错误,
故选A.

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
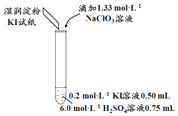
(1)取实验2后的溶液,进行如图实验: 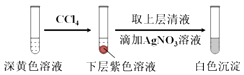
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 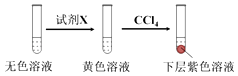
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .