ΧβΡΩΡΎ»ί
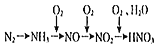
ΓΨΧβΡΩΓΩœ÷»Γm gΟΨ¬ΝΚœΫπ‘Ύ“ΜΕ®≈®Ε»ΒΡœΓœθΥα÷–«ΓΚΟΆξ»Ϊ»ήΫβ(œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NO)Θ§œρΖ¥”ΠΚσΒΡΜλΚœ»ή“Κ÷–ΒΈΦ”b mol/LNaOH»ή“ΚΘ§Β±ΒΈΦ”ΒΫV mL ±Θ§ΒΟΒΫ≥ΝΒμ÷ ΝΩ«ΓΚΟΈΣΉν¥σ÷Βn g Θ§‘ρœ¬Ν–”–ΙΊΗΟΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ”–Θ® Θ©
A.±ξΉΦΉ¥Ωωœ¬…ζ≥…NΒΡΧεΜΐΈΣ![]() L
L
B.≥ΝΒμ÷–OH-ΒΡ÷ ΝΩΈΣ17bVg
C.«ΓΚΟ»ήΫβΚσ»ή“Κ÷–ΒΡNO3-ΒΡΈο÷ ΒΡΝΩΈΣ![]() mol
mol
D.”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ(![]() +
+![]() )mol
)mol
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
AΓΔΗυΨίΒγΉ” ΊΚψ‘≠άμΘ§…ζ≥…NO ±Θ§![]() ÷–
÷–![]() ΦέΒΡN‘≠Ή”ΒΟ3ΗωΒγΉ”Θ§“ρ¥Υ…ζ≥…NOΒΡΈο÷ ΒΡΝΩ”ΠΗΟ «ΉΣ“ΤΒγΉ”ΒΡ»ΐΖ÷÷°“ΜΘ§Φ¥
ΦέΒΡN‘≠Ή”ΒΟ3ΗωΒγΉ”Θ§“ρ¥Υ…ζ≥…NOΒΡΈο÷ ΒΡΝΩ”ΠΗΟ «ΉΣ“ΤΒγΉ”ΒΡ»ΐΖ÷÷°“ΜΘ§Φ¥![]() Θ§ΤδΧεΜΐ‘Ύ±ξΉΦΉ¥Ωωœ¬ΈΣ
Θ§ΤδΧεΜΐ‘Ύ±ξΉΦΉ¥Ωωœ¬ΈΣ![]() Θ§Ι A’ΐ»ΖΘΜ
Θ§Ι A’ΐ»ΖΘΜ
BΓΔ≥ΝΒμΈΣ«β―θΜ·¬ΝΚΆ«β―θΜ·ΟΨΘ§≥ΝΒμ÷ ΝΩΒ»”Ύ¬ΝΟΨΚœΫπ÷ ΝΩ”κ«β―θΗυ÷ ΝΩ÷°ΚΆΘ§Υυ“‘≥ΝΒμ÷–«β―θΗυΒΡ÷ ΝΩΈΣ![]() gΘ§Μρ’ΏΒ»”Ύ17bV
gΘ§Μρ’ΏΒ»”Ύ17bV![]() 10-3gΘ§Ι B¥μΈσΘΜ
10-3gΘ§Ι B¥μΈσΘΜ
CΓΔ«ΓΚΟ»ήΫβΚσ»ή“Κ÷–ΒΡ![]() άκΉ”ΒΡΈο÷ ΒΡΝΩΒ»”Ύ≥ΝΒμ÷ ΝΩΉν¥σ»ή“Κ÷–
άκΉ”ΒΡΈο÷ ΒΡΝΩΒ»”Ύ≥ΝΒμ÷ ΝΩΉν¥σ»ή“Κ÷–![]() άκΉ”ΒΡΈο÷ ΒΡΝΩΘ§Β±≥ΝΒμΝΩΉν¥σ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ÷Μ”–œθΥαΡΤ
άκΉ”ΒΡΈο÷ ΒΡΝΩΘ§Β±≥ΝΒμΝΩΉν¥σ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ÷Μ”–œθΥαΡΤ![]() Θ§œθΥαΗυάκΉ””κΡΤάκΉ”ΒΡΈο÷ ΒΡΝΩœύΒ»Θ§
Θ§œθΥαΗυάκΉ””κΡΤάκΉ”ΒΡΈο÷ ΒΡΝΩœύΒ»Θ§![]() Θ§Ι C’ΐ»ΖΘΜ
Θ§Ι C’ΐ»ΖΘΜ
DΓΔ≤ΈΦ”Ζ¥”ΠΒΡœθΥα”–ΝΫ÷÷Ής”ΟΘ§ΤπΥαΚΆ―θΜ·ΦΝΉς”ΟΘ§ΉςΈΣΥαΒΡœθΥα![]() …ζ≥…œθΥα―Έ
…ζ≥…œθΥα―Έ![]() ΒΡΈο÷ ΒΡΝΩΒ»”ΎœθΥαΡΤΒΡΈο÷ ΒΡΝΩΈΣ
ΒΡΈο÷ ΒΡΝΩΒ»”ΎœθΥαΡΤΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Ής―θΜ·ΦΝΒΡœθΥαΒΡΈο÷ ΒΡΝΩΒ»”ΎNOΒΡΈο÷ ΒΡΝΩΈΣ
Θ§Ής―θΜ·ΦΝΒΡœθΥαΒΡΈο÷ ΒΡΝΩΒ»”ΎNOΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Υυ“‘”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ
Θ§Υυ“‘”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Ι D’ΐ»ΖΓΘ
Θ§Ι D’ΐ»ΖΓΘ
¥πΑΗΘΚBΓΘ

ΓΨΧβΡΩΓΩΓΑ84Γ±œϊΕΨ“Κ(ΙΛ“Βάϊ”ΟCl2”κNaOHΖ¥”Π÷ΤΒΟΘ©Ω…”Ο”ΎœϊΕΨΚΆΤ·ΑΉΘ§œ¬Ν– Β―ιœ÷œσΒΡΖ÷Έω≤Μ’ΐ»ΖΒΡ «
Β―ι≤ΌΉς |
|
|
|
Β―ιœ÷œσ | ΜλΚœΚσ»ή“ΚΒΡpH=9.9,ΕΧ ±ΦδΡΎΈ¥Ά …ΪΘ§“ΜΕΈ ±ΦδΚσάΕ…ΪΆ »ΞΓΘ | ΜλΚœΚσ»ή“ΚpH=5.0Θ§άΕ…Ϊ―ΗΥΌΆ »ΞΘ§ΈόΤχΧε≤ζ…ζΓΘ | ΜλΚœΚσ»ή“ΚpH=3.2Θ§άΕ…Ϊ―ΗΥΌΆ »ΞΘ§≤Δ≤ζ…ζ¥σΝΩΤχΧεΘ§ Ι Σ»σΒΡΒμΖέΒβΜ·ΦΊ ‘÷Ϋ±δάΕΓΘ |
A.Ε‘±» Β―ιΔΌΚΆΔΎΘ§ΔΎ÷–άΕ…Ϊ―ΗΥΌΆ »ΞΒΡ‘≠“ρ «ΖΔ…ζΝΥΖ¥”ΠClO+H+®THClO
B. Β―ιΔέ÷–≤ζ…ζΒΡΤχΧε «Cl2Θ§”…HClOΖ÷ΫβΒΟΒΫΘΚ2HClO®TCl2Γϋ+H2O
C.Ε‘±» Β―ιΔΎΚΆΔέΘ§»ή“ΚΒΡpHΩ…ΡήΜα”ΑœλClOΒΡ―θΜ·–‘ΜρClΒΡΜΙ‘≠–‘
D.Φ”ΥαΩ…“‘ΧαΗΏΓΑ84Γ±œϊΕΨ“ΚΒΡΤ·ΑΉ–ßΙϊΘ§ΒΪ–η“ΣΒςΩΊΚœ ΒΡpH≤≈ΡήΑ≤»Ϊ Ι”Ο