题目内容
5.相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是( )①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
分析 ①纯的锌与酸反应速率较慢;
②粗锌片中含有杂质,可以形成原电池,反应速率加快;
③与④相比,氢离子浓度虽然较小,但能生成氢气;
④98%的浓硫酸,虽然氢离子浓度较大,但浓硫酸与锌生成二氧化硫,不生成氢气;
⑤加热可以加快反应速率;
⑥温度低,反应速率慢.
解答 解:①纯锌粒,与酸反应,不能形成原电池,速率较慢,故①错误;
②粗锌片,含有的杂质可以形成原电池,加快了反应速率,故②正确;
③0.1mol•L-1硫酸,氢离子浓度虽然较小,但能生成氢气,故③正确;
④98%硫酸,由于浓硫酸与锌反应生成的是二氧化硫,不能生成氢气,故④错误;
⑤加热,温度较高,反应速率加快,故⑤正确;
⑥用冰水冷却,温度降低,反应速率减小,故⑥错误;
以上符合题意的有②③⑥,
故选B.
点评 本题考查了影响化学反应速率的影响,注重了基础知识的考查,本题难度中等.

练习册系列答案
相关题目
16.下列各装置能够达到相应实验目的是( )
| A. | 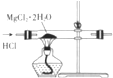 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 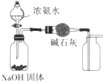 制取并收集干燥纯净的NH3 | D. | 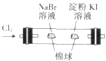 证明氧化性:Cl2>Br2>I2 |
13.常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是( )
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
20.下列与有关非金属元素叙述以及推理结果不正确的是( )
| A. | 非金属性Cl>Br,故将Cl2通入NaBr溶液中,发生反应为:Cl2+2Br-=Br2+2Cl- | |
| B. | 非金属性F>Br,故酸性:HF>HBr | |
| C. | 非金属性S>33As,故前者的气态氢化物稳定性更强 | |
| D. | 非金属性O>N,故O2与H2化合比N2更容易 |
10.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标志是:(分别用V表示正反应速率,V╯表示逆反应速率)( )
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
17.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: | B. | CO2的比例模型: | ||
| C. | 14C的原子结构示意图: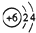 | D. | CCl4的结构式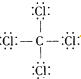 |
14.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| B. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
6.能说明氯的非金属性比硫强的事实是( )
| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
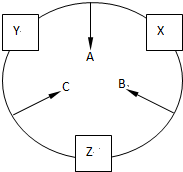 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.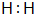
 NH4++OH-.
NH4++OH-.