题目内容
14.我国规定饮用水质量标准必须符合下列要求:| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5mol•L-1 |
| 细菌总数 | <100个/mL |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
分析 (1)源水中存在Ca2+,Mg2+,HCO-3,Cl-,溶质为Ca(HCO3)2,Mg(HCO3)2,CaCl2,MgCl2,分别与Ca(OH)2发生复分解反应,化学方程式为:?Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O;?Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O;?MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2?.根据以上三个反应可以写出离子方程式:?Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓.?
(2)常用明矾、FeCl3溶液作源水的凝聚剂,利用Al3+或Fe3+水解成Al(OH)3或Fe(OH)3胶体吸附水中悬浮的固体颗粒,这一过程既有化学变化又有物理变化,如果用FeSO4•7H2O作凝聚剂,Fe2+发生水解:Fe2++2H2O?Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀.
(3)通入CO2的目的是调节pH和进一步除去水中的Ca2+.?
(4)通入气体A用于对源水杀菌消毒,气体A必须有强氧化性.??
(5)代替A气体的物质必须有强氧化性,可选择Ca(ClO)2,K2FeO4,O3等.?
解答 解:(1)源水中存在Ca2+,Mg2+,HCO-3,Cl-,溶质为Ca(HCO3)2,Mg(HCO3)2,CaCl2,MgCl2,分别与Ca(OH)2发生复分解反应,化学方程式为:?Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O;?Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O;?MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2?.根据以上三个反应可以写出离子方程式:?Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓.
故答案为:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀,则既发生物理变化又发生化学变化,且亚铁离子与碱反应生成沉淀易被氧化为红褐色沉淀Fe(OH)3,
故答案为:③;胶状Fe(OH)3;
(3)通入二氧化碳,增大溶液中碳酸根离子浓度,则与钙离子反应生成沉淀,从而除去钙离子,并降低溶液的碱性,调节溶液的酸碱度,
故答案为:除去除去Ca2+;调节PH值;
(4)氯气与水反应生成盐酸和次氯酸,该反应为Cl2+H2O═HCl+HClO,HClO具有强氧化性,能杀菌消毒,
故答案为:强氧化;Cl2+H2O=H++Cl-+HClO;
(5)氯气具有强氧化性,能杀菌消毒,则作为Cl2的替代品的物质需具有强氧化性,选项中只有①③具有强氧化性,
故答案为:①③.
点评 本题考查自来水的净化及离子之间的饭,明确净化原理及各物质的性质、发生的化学反应是解答本题的关键,(2)为解答的难点,题目难度中等.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA | |
| B. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
| A. | 甲烷、辛醛 | B. | 乙炔、苯乙烯 | C. | 乙烯、乙烷 | D. | 苯、甲苯 |
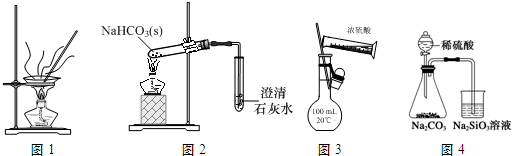
| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
| A. | C2H6 | B. | C6H6 | C. | C2H4 | D. | C2H2 |
 (1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
(1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
 钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
 .
.