题目内容
700℃时,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
A、反应在t1 min内的反应速率为v(H2)=
| ||
| B、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | ||
| D、温度升高至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应 |
分析:A.由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,根据v=
计算v(CO),再根据速率之比等于化学计量数之比计算v(CO2);
B.依据化学平衡三段式列式计算;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
D.t1min时反应已经达到平衡状态,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,比较不同温度下的平衡常数大小判断反应的热效应.
| ||
| △t |
B.依据化学平衡三段式列式计算;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
D.t1min时反应已经达到平衡状态,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,比较不同温度下的平衡常数大小判断反应的热效应.
解答:解:A.由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,v(CO)=
=
=
mol/(L?min),速率之比等于化学计量数之比,故v(CO2)=v(H2)=
mol/(L?min),故A错误;
B. CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol) 1.2 0.6 0 0
变化量(mol) 0.4 0.4 0.4 0.4
平衡量(mol) 0.8 0.2 0.4 0.4
t1min时n(CO)=0.8mol,则水n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,体积为2L,计算式中可以用物质的量代替浓度计算平衡常数K=
=1;
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol) 0.6 1.2 0 0
变化量(mol) x x x x
平衡量(mol) 0.6-x 1.2-x x x
体积为2L,计算式中可以用物质的量代替浓度计算平衡常数
K=
=1,x=0.4mol;
故B正确;
C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;
D、依据B计算,700°C时反应的平衡常数K=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;
故选B.
| ||
| △t |
| ||
| t1min |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
B. CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol) 1.2 0.6 0 0
变化量(mol) 0.4 0.4 0.4 0.4
平衡量(mol) 0.8 0.2 0.4 0.4
t1min时n(CO)=0.8mol,则水n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,体积为2L,计算式中可以用物质的量代替浓度计算平衡常数K=
| 0.4×0.4 |
| 0.8×0.2 |
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol) 0.6 1.2 0 0
变化量(mol) x x x x
平衡量(mol) 0.6-x 1.2-x x x
体积为2L,计算式中可以用物质的量代替浓度计算平衡常数
K=
| x2 |
| (0.6-x)(1.2-x) |
故B正确;
C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;
D、依据B计算,700°C时反应的平衡常数K=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;
故选B.
点评:本题考查化学反应速率计算、平衡状态判断、等效平衡、平衡常数计算与应用,注意平衡常数的计算应用与影响因素分析,难度中等.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
|
700℃时,在容积为2 L的密闭容器中发生反应CO(g)
+ H2O(g) CO2(g)
+ H2(g),部分数据见下表(表中t2>t1):
CO2(g)
+ H2(g),部分数据见下表(表中t2>t1):
|
反应时间/min |
n(CO)/mol |
n(H2O)/mol |
n(CO2)/mol |
n(H2)/mol |
|
0 |
1.20 |
0.60 |
0 |
0 |
|
t1 |
0.80 |
|
|
|
|
t2 |
|
0.20 |
|
|
下列说法正确的是
A.反应在t1 min内的反应速率为v(H2)=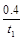 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应