题目内容
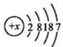
17.等量的氢氧化钠溶液分别用pH=2和pH=3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的为( )| A. | Va>10 Vb | B. | Vb=10Va | C. | Vb<10 Va | D. | Vb>10 Va |
分析 醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大;等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,二者物质的量相等,据此列式计算.
解答 解:等量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,浓度越大,电离程度越小,则pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,
设pH为2的醋酸浓度为x,pH=3的醋酸浓度为y,则有Va×x=Vb×y,
则$\frac{{V}_{a}}{{V}_{b}}$=$\frac{y}{x}$<$\frac{1}{10}$,
即Vb>10Va,
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意浓度不同的醋酸,电离程度不同,浓度越大,电离程度越小,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列各组物质的分类正确的是( )
①混合物:氯水、氨水、汽油 ②电解质:硫酸钡、无水H2SO4、苛性钠
③含非极性键分子:CO2、CH2Cl2、苯 ④同素异形体:C60、金刚石、石墨.
①混合物:氯水、氨水、汽油 ②电解质:硫酸钡、无水H2SO4、苛性钠
③含非极性键分子:CO2、CH2Cl2、苯 ④同素异形体:C60、金刚石、石墨.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | 全部 |
8.在25℃时,用蒸馏水稀释1mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$ | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(OH-) |
9.以下反应最符合绿色化学原子经济性(即:原子利用率为100%)要求的是( )
| A. | 甲苯与硝酸制TNT | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 溴乙烷水解制乙醇 | D. | 乙烯聚合为聚乙烯高分子材料 |
6.已知乙烯分子中含有一个碳碳双键,分子呈平面结构,六个原子都在同一平面上,下列对丙烯(CH3-CH═CH2)结构和性质的推断正确的是( )
| A. | 丙烯分子中所有的原子都在同一平面上 | |
| B. | 丙烯分子中三个碳原子有可能在同一条直线上 | |
| C. | 过量的丙烯通入浓溴水中,观察到溴水褪色,溶液均一稳定 | |
| D. | 丙烯既可以发生加成反应,又可以发生取代反应 |
7.下列说法中正确的是( )
| A. | 所有铵盐受热均可以分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液共热,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物,可用升华法分离 |
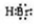 、CaBr2:
、CaBr2: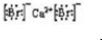 .
. 和
和
 和
和