题目内容
利用下列图表中的实验装置和试剂,能得出正确实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 饱和食盐水 | 电石 | 溴水 | 乙炔和溴水发生加成反应 | |
| B | 浓盐酸 | KMnO4 | FeCl2溶液 | 氧化性:MnO4->Cl2>Fe3+ | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,非金属在元素周期表中的位置及其性质递变的规律,氧化性、还原性强弱的比较,乙炔炔烃,铝金属及其化合物的性质实验
专题:实验评价题
分析:A.电石与饱和食盐水制得的气体中含硫化氢;
B.高锰酸钾能将浓盐酸氧化生成氯气,氯气能将氯化亚铁氧化生成氯化铁;
C.Al(OH)3能溶于强酸和强碱而体现两性;
D.盐酸具有挥发性,制取的二氧化碳中含有HCl.
B.高锰酸钾能将浓盐酸氧化生成氯气,氯气能将氯化亚铁氧化生成氯化铁;
C.Al(OH)3能溶于强酸和强碱而体现两性;
D.盐酸具有挥发性,制取的二氧化碳中含有HCl.
解答:
解:A.电石与饱和食盐水制得的气体中含硫化氢,则溴水褪色,不一定为乙炔与溴水的反应,故A错误;
B.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3,所以氧化性MnO4->Cl2>Fe3+,故B正确;
C.Al(OH)3能溶于强酸和强碱而体现两性,浓氨水滴入生石灰固体上得到氨气,氨气和氯化铝反应生成Al(OH)3,不能说明Al(OH)3具有两性,故C错误;
D.盐酸和碳酸钠反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有HCl,二氧化碳和HCl都能和碳硅酸钠溶液反应生成硅酸,所以不能证明非金属性:Cl>C>Si,故D错误;
故选B.
B.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3,所以氧化性MnO4->Cl2>Fe3+,故B正确;
C.Al(OH)3能溶于强酸和强碱而体现两性,浓氨水滴入生石灰固体上得到氨气,氨气和氯化铝反应生成Al(OH)3,不能说明Al(OH)3具有两性,故C错误;
D.盐酸和碳酸钠反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有HCl,二氧化碳和HCl都能和碳硅酸钠溶液反应生成硅酸,所以不能证明非金属性:Cl>C>Si,故D错误;
故选B.
点评:本题考查较综合,涉及氧化性强弱判断、物质的性质、非金属性强弱的判断等知识点,明确物质之间的反应及物质的性质即可解答,注意D中HCl对二氧化碳的干扰,为易错点.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列溶液中,跟100mL0.5mol?L-1NaNO3溶液所含的NO3-物质的量浓度相同的是( )
| A、100mL0.5mol?L-1Mg(NO3)2溶液 |
| B、200mL1mol?L-1Ca(NO3)2溶液 |
| C、50mL1mol?L-1NaNO3溶液 |
| D、25mL0.5mol?L-1HNO3溶液 |
下列分子或离子中,含有孤电子对最多的是( )
| A、H2O |
| B、BeCl2 |
| C、SiH4 |
| D、NH4+ |
下列有关化学用语使用正确的是( )
| A、乙醇的分子式:C2H5OH |
B、乙烯的比例模型: |
C、CO2的电子式: |
D、钾原子结构示意图: |
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
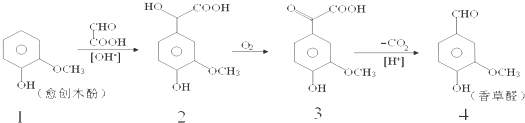
下列说法正确的是( )

下列说法正确的是( )
| A、反应1→2中原子利用率为90% |
| B、检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 |
| C、化合物2在一定条件下可发生酯化反应 |
| D、等物质的量四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比1:4:3:2 |
X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的最外层电子数是次外层的两倍,也是X、W最外层电子数之和的两倍,Z是地壳中含量最多的元素,R的单核离子在同周期元素形成的单核离子中半径最小.以下说法中正确的是( )
| A、R形成的盐一定不能与Y的最高价氧化物对应的水化物发生反应 |
| B、Z、W形成的化合物中只有一种类型的化学键 |
| C、Y、Z的氢化物的稳定性Y<Z |
| D、X的原子半径一定小于Z |
在周期表的前10号元素中,两种元素所在周期数之比等于它们所在的族序数之比,满足这种关系的元素共有( )
| A、1对 | B、2对 | C、3对 | D、4对 |
 (1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
(1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.