题目内容
现有25℃时0.1mol?L![]() 的氨水。请回答以下问题:
的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式
;所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因 ;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol?L![]() ,则c(SO4
,则c(SO4![]() ) ;
) ;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是 。
(1)减小
(2)NH3?H2O+H+===NH4++H2O; <;
NH4++H2O![]() NH3?H2O+H+
NH3?H2O+H+
(3)![]() mol/L
mol/L
(4)c(NH4+)>c(SO42一)>c(H+)>c(OH一)

练习册系列答案
相关题目
 (填“增大”“减小”“不变”).
(填“增大”“减小”“不变”). ]=a mol?L-1,则[SO
]=a mol?L-1,则[SO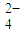 ]= .
]= .