题目内容
20.将甲、乙两种金属的性质相比较,已知:①甲与水反应比乙与水反应剧烈;
②甲单质能从乙的盐溶液中置换出乙单质;
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物的碱性强;
④与某非金属反应时甲比乙失电子数多;
⑤甲单质的熔沸点比乙单质的低.
能说明甲的金属性比乙强的是①②③.
分析 元素的金属性越强,其最高价氧化物的水化物碱性越强,与水或酸置换出氢气越容易,较活泼金属能置换出较不活泼金属,据此分析解答.
解答 解:①元素的金属性越强,其与水反应越剧烈,甲与H2O反应比乙与H2O反应剧烈,说明甲的金属性活动性大于乙,故正确;
②较活泼金属能置换出较不活泼金属,甲单质能从乙的盐溶液中置换出单质乙,说明甲的还原性大于乙,则金属甲大于乙,故正确;
③元素的金属性越强,其最高价氧化物的水化物碱性越强,甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强,说明甲的金属性大于乙,故正确;
④金属性强弱与失电子难易程度有关,与失电子多少无关,故错误;
⑤金属性强弱与失电子难易程度有关,与单质的熔、沸点无关,故错误;
故答案为:①②③.
点评 本题考查金属的金属性强弱判断,为高频考点,明确金属性强弱判断规律是解本题关键,注意:金属性强弱与失电子难易程度有关,与失电子多少无关,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
8.加入适量的H2SO4溶液,可使溶液中下列离子的数目显著减少的是( )
| A. | Cl- | B. | Na+ | C. | CO32- | D. | SO42- |
15.在高温下用一氧化碳还原mg四氧化三铁得到ng铁.已知氧的相对原子质量为16,则铁的相对原子质量为( )
| A. | $\frac{21n}{m-n}$ | B. | $\frac{64n}{3(m-n)}$ | C. | $\frac{m-n}{32n}$ | D. | $\frac{24n}{m-n}$ |
5.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是( )
| A. | Y的价层电子排布式为3s23p5 | |
| B. | 稳定性:Y的氢化物>Z的氢化物 | |
| C. | 第一电离能:Y<Z | |
| D. | X、Y两元素形成的化合物为离子化合物 |
10.下列物质中所含分子物质的量最多的是( )
| A. | 56 g N2 | B. | 3.36 L O2 | ||
| C. | 6 g H2 | D. | 3.01×1023个H2SO4分子 |
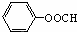 (写出结构简式).
(写出结构简式). +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+ .
. .
.

 ;
; +CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O; .
.