题目内容
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
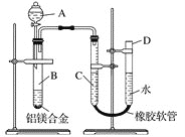
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________________________。
(3)B中发生反应的化学方程式为___________________。
(4)若实验用的铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为________。
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______(填“偏大”“偏小”或“不受影响”)。
【答案】氢氧化钠溶液 除去铝镁合金表面的氧化膜 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ![]() 偏小
偏小
【解析】
根据实验目的,要测定铝镁合金中铝的质量分数和铝的相对原子质量,需要选用一种试剂只能铝反应,不能与镁反应,因此可以需要氢氧化钠溶液,结合2Al+2NaOH+2H2O=2NaAlO2+3H2↑分析解答。
(1)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但镁与氢氧化钠溶液不反应,铝能与NaOH溶液反应放出氢气,因此要测定铝镁合金中铝的质量分数,应选择NaOH溶液,故答案为:NaOH溶液;
(2)铝镁是活泼的金属,表面容易形成一层氧化膜,在实验前需要除去,故答案为:除去铝镁合金表面的氧化膜;
(3)B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则

有![]() =
=![]() ,解得:M=
,解得:M=![]() ,故答案为:
,故答案为:![]() ;
;
(5)铝的质量分数为![]() ×100%,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,则铝的质量分数偏小,故答案为:偏小。
×100%,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,则铝的质量分数偏小,故答案为:偏小。

【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4kJ/mol
2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子断裂2NA个H-O键,同时氢分子断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正_______v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=_______%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=_______;KA、KB、KC三者之间的大小关系为________。

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%。
×100%。
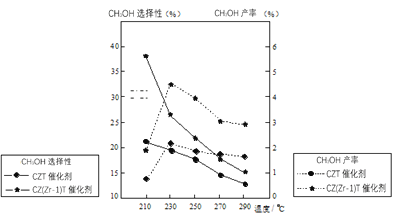
①温度高于230℃,CH3OH产率随温度升高而下降的原因是______。
②在上述条件下合成甲醇的工业条件是_______。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
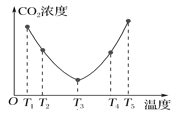
(6)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2 效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则ΔH______0(填“>”、“=”或“<”)。