题目内容
20.下列描述或表达式正确的是( )| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | NaHSO4在稀溶液中的电离方程式:NaHSO4═Na++H++SO42- | |
| C. | 电解、电泳、电离、电化腐蚀等过程均需要通电才进行 | |
| D. | 对于反应 MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O,每有1molMnO2被氧化,转移2mol 电子 |
分析 A.电解质的强弱与溶解性无关,硫酸钙、硫酸钡熔融状态完全电离;
B.NaHSO4在稀溶液中完全电离成钠离子、氢离子和硫酸根离子;
C.电离是水分子作用下或熔融状态发生的电离,电化腐蚀是形成原电池反应发生的腐蚀;
D.Mn元素的化合价降低,被还原;
解答 解:A.电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4熔融状态完全电离均是强电解质,故A错误;
B.NaHSO4在稀溶液中完全电离成钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4═Na++H++SO42-,故B正确;
C.电解、电泳等过程均需要通电才进行,电离、电化腐蚀不需要通电,故C错误;
D.反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中Mn元素的化合价降低,被还原,则1molMnO2被还原转移2mol电子,故D错误;
故选B.
点评 本题考查了氧化还原反应、电解质强弱的判断、电解质电离方程式的书写等,题目难度不大,侧重于基础知识的考查,注意把握有关的基础知识.

练习册系列答案
相关题目
7.能与铝作用放出氢气的溶液中,可能大量共存的离子组是( )
| A. | NH4+、Mg2+、NO3-、Cl- | B. | Cu2+、Na+、HCO3-、Br- | ||
| C. | Na+、Fe2+、SO42-、NO3- | D. | K+、Na+、AlO2-、Cl- |
11. 25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )
25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )
 25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )
25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )| A. | 根据图示可计算出Ksp(Ag2CO3)=9×10-9 | |
| B. | 向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点 | |
| C. | 反应Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 | |
| D. | 在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
8.下列关于硅及其化合物的叙述正确的是( )
| A. | 陶瓷、玻璃、水泥都是硅酸盐产品 | |
| B. | 水晶、玛瑙、光纤、硅胶的主要成分都是SiO2 | |
| C. | SiO2很稳定,与所有的酸都不反应 | |
| D. | 单质硅是制作光导纤维的材料 |
15.某有机物的结构简式为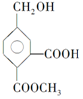 ,它在一定条件下可发生的反应为( )
,它在一定条件下可发生的反应为( )
①酯化反应 ②氧化反应 ③加聚反应 ④取代反应.
 ,它在一定条件下可发生的反应为( )
,它在一定条件下可发生的反应为( )①酯化反应 ②氧化反应 ③加聚反应 ④取代反应.
| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
5.下列关于有机物的说法正确的是( )
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl |
12.设NA表示阿伏加得罗常数,下列叙述正确的是( )
| A. | 标准状况下,1mol氦气所含的原子数为2NA | |
| B. | 1.8g NH4+离子中所含的电子数为1.1NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | NA个氮分子和NA个氢分子的体积相同 |
9.下列物质在一定条件下能和氢氧化钠溶液发生反应的是( )
| A. | 汽油 | B. | 色拉油 | C. | 甘油 | D. | 机油 |
10.已知有A、B、C、D、E五种短周期元素,其原子序数依次增大,A与B形成的共价化合物的水溶液呈碱性,C元素原子的最内层电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6.下列叙述中错误的是( )
| A. | B元素的简单气态氢化物与E的氢化物化合,生成物的水溶液呈酸性 | |
| B. | B、C、E最高价氧化物对应的水化物溶液均能与D元素的氧化物反应 | |
| C. | 元素B、E分别与元素A构成的含有18个电子的分子中均含有非极性共价键 | |
| D. | 最高价氧化物对应水化物的碱性:C>D |