题目内容
【题目】短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是
A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质
B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D)
C.B、D 的最高价氧化物中,B、D 与氧原子均为双键
D.D 元素处于元素周期表中第 3 周期第Ⅳ族
【答案】A
【解析】
短周期元素 A、B、C、D 的原子序数依次递增,A与C同主族,B与D同主族,则B为第二周期元素,D为第三周期元素;B为第二周期元素,B 原子的次外层电子数为2,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,则A为H元素,C为Na元素;原子最外层电子数之和为10,则B为C元素,D为Si元素,它们的核电荷数之和为32,即1+6+11+14=32,符合题意,据此分析解答。
根据上述分析,A为H元素,B为C元素,C为Na元素,D为Si元素。
A.因C+SiO2 ![]() Si+2CO↑,2Na+2H2O═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故A正确;
Si+2CO↑,2Na+2H2O═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故A正确;
B.电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则原子半径C>D>B>A,故B错误;
C.因二氧化碳中存在C=O键,而二氧化硅中不存在双键,只有Si-O键,故C错误;
D.因硅有3个电子层,最外层电子数为4,则D在周期表中位于第三周期第ⅣA族,故D错误;
故选A。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如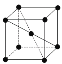 所示,1183 K以上转变为
所示,1183 K以上转变为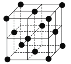 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。