题目内容
8.含有6.02×1023个OH-的Ba(OH)2的物质的量是0.5mol,质量是85.5g.分析 先根据n=$\frac{N}{{N}_{A}}$计算出6.02×1023个OH-的物质的量,然后根据n[Ba(OH)2]=$\frac{1}{2}$n(OH-)计算出Ba(OH)2的物质的量,最后根据m=nM计算出氢氧化钡的质量.
解答 解:6.02×1023个OH-的物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,则Ba(OH)2的物质的量为:n[Ba(OH)2]=$\frac{1}{2}$n(OH-)=1mol×$\frac{1}{2}$=0.5mol,
0.5molBa(OH)2的质量为:m[Ba(OH)2]=171g/mol×0.5mol=85.5g,
故答案为:0.5mol;85.5g.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O |
13.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_8^{18}{O_2}$,下列说法正确的是( )
| A. | 它与${\;}_8^{16}{O_2}$的物理性质完全相同 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_8^{18}{O_2}$与${\;}_8^{16}{O_2}$互为同位素 | |
| D. | 1mol${\;}_8^{18}{O_2}$分子中含有20mol电子 |
20. 维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )
维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )
 维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )
维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )| A. | 维生素A能使溴水褪色 | |
| B. | 维生素A能与金属钠发生反应并放出氢气 | |
| C. | 维生素A的一个分子中有3个双键 | |
| D. | 维生素A能使酸性高锰酸钾溶液褪色 |
17.在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前后物质的总质量⑥反应前后反应体系的总能量.
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前后物质的总质量⑥反应前后反应体系的总能量.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
19.下列离子在溶液中能大量共存的是( )
| A. | Na+、Ba2+、CO32-、SO42- | B. | K+、Ag+、H+、Cl- | ||
| C. | Al3+、H+、NO3-、SO42- | D. | Fe3+、K+、OH-、NO3- |
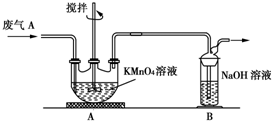 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.