题目内容
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、![]() 杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:
杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:
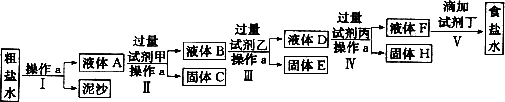
请回答以下问题:
(1)操作a的名称是________,所用玻璃仪器有_______.
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为________(填化学式)溶液.
(3)写出固体H所含物质的化学式:________.
答案:
解析:
解析:
|
答案:(1)过滤;玻璃棒、漏斗、烧杯.(2)NaOH.(3)CaCO3、BaCO3. 解析:(1)把泥沙等不溶性杂质与溶液分离的操作是过滤,过滤操作中所需的玻璃仪器是玻璃棒、漏斗、烧杯. (2)加入试剂甲后生成了两种沉淀,则甲为NaOH,生成的两种大量的沉淀是Mg(OH)2和Fe(OH)3. (3)试剂乙为BaCl2溶液,以除去溶液中所含的 评注:本题考查了除去粗盐中各种杂质离子所需的试剂,解题时要注意所加试剂的先后顺序对实验的影响,一般来说,先除Mg2+、Fe3+、 |

练习册系列答案
相关题目

 请回答以下问题:
请回答以下问题:
 请回答以下问题:
请回答以下问题: