题目内容
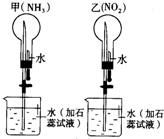 同温同压下,在甲、乙两个等体积的干燥圆底烧瓶中分别充满NH3、NO2 进行喷泉实验.如图:
同温同压下,在甲、乙两个等体积的干燥圆底烧瓶中分别充满NH3、NO2 进行喷泉实验.如图:(1)实验室制备NH3的化学方程式为:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
(2)形成喷泉后,甲烧瓶内液体呈
蓝
蓝
色,原因是NH3+H2O═NH3.H2O═NH4++OH-
NH3+H2O═NH3.H2O═NH4++OH-
(用化学方程式说明);乙烧瓶内液体呈红
红
色,原因是3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
(用化学方程式说明)(3)喷泉停止后,甲烧瓶中溶质的物质的量浓度
等于
等于
(填“大于”“小于”或“等于”)乙烧瓶中溶质的物质的量浓度.分析:( 1)实验室用氯化铵和氢氧化钙加热来制取氨气;
(2 )氨气溶于水后,氨气和水反应生成氨水,氨水电离生成铵根离子和氢氧根离子单质溶液呈碱性,石蕊遇碱变蓝色;二氧化氮和水反应生成硝酸和一氧化氮,硝酸溶液呈酸性,石蕊遇酸变红色;
(3)设烧瓶的体积为V,根据C=
=
=
计算氨水的物质的量浓度.
(2 )氨气溶于水后,氨气和水反应生成氨水,氨水电离生成铵根离子和氢氧根离子单质溶液呈碱性,石蕊遇碱变蓝色;二氧化氮和水反应生成硝酸和一氧化氮,硝酸溶液呈酸性,石蕊遇酸变红色;
(3)设烧瓶的体积为V,根据C=
| n |
| V |
| ||
| V |
| 1 |
| Vm |
解答:解:( 1)实验室用氯化铵和氢氧化钙加热来制取氨气2NH4Cl+Ca(OH)2
CaCl2+2 NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2 NH3↑+2H2O;
(2 ) 氨气溶于水后,氨气和水反应生成氨水,氨水电离生成铵根离子和氢氧根离子单质溶液呈碱性,NH3+H2O═NH3.H2O═NH4++OH-,石蕊遇碱变蓝色;二氧化氮和水反应生成硝酸和一氧化氮,硝酸溶液呈酸性,石蕊遇酸变红色3NO2+H2O=2HNO3+NO,
故答案为:蓝;NH3+H2O═NH3.H2O═NH4++OH-;红;3NO2+H2O=2HNO3+NO;
(3)气体和水反应的体积就等于水进入烧瓶的体积,根据公式C=
=
=
知,溶液的物质的量浓度与气体摩尔体积有关,与气体的体积无关,所以相同条件下,两种溶液的物质的量浓度相等.
故答案为:等于.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2 ) 氨气溶于水后,氨气和水反应生成氨水,氨水电离生成铵根离子和氢氧根离子单质溶液呈碱性,NH3+H2O═NH3.H2O═NH4++OH-,石蕊遇碱变蓝色;二氧化氮和水反应生成硝酸和一氧化氮,硝酸溶液呈酸性,石蕊遇酸变红色3NO2+H2O=2HNO3+NO,
故答案为:蓝;NH3+H2O═NH3.H2O═NH4++OH-;红;3NO2+H2O=2HNO3+NO;
(3)气体和水反应的体积就等于水进入烧瓶的体积,根据公式C=
| n |
| V |
| ||
| V |
| 1 |
| Vm |
故答案为:等于.
点评:本题考查了氨气和二氧化氮的性质,难点是比较两种溶液的物质的量浓度,能灵活运用公式C=
=
=
,得出物质的量浓度与气体的体积无关,只与气体摩尔体积有关,即可解答本题.
| n |
| V |
| ||
| V |
| 1 |
| Vm |

练习册系列答案
相关题目
 同温同压下,在甲、乙两个等体积的干燥圆底烧瓶中分别充满NH3、NO2 进行喷泉实验.如图:
同温同压下,在甲、乙两个等体积的干燥圆底烧瓶中分别充满NH3、NO2 进行喷泉实验.如图:
