题目内容
 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:(1)合金中铝的质量为
(2)盐酸的物质的量浓度(假设反应后溶液体积不变)是
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:图示题
分析:由图象可知,加入NaOH溶液100mL~700mL时,发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,加入NaOH800mL时,发生Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH100mL,此时n(NaOH)=0.1L×2mol/L=0.2mol,以此可计算Al3+的物质的量,根据结合反应的离子方程式计算铝的质量;当加入NaOH700mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,以此计算盐酸的物质的量浓度.
解答:
解:(1)加入NaOH800mL时,发生Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH100mL,此时n(NaOH)=0.1L×2mol/L=0.2mol,
则n(Al3+)=n(Al(OH)3)=0.2mol,m(Al)=0.2mol×27g/mol=5.4g;
故答案为:5.4;
(2)由图象可知,当加入NaOH700mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,则n(NaCl)=n(NaOH)=0.7L×2moL/L=1.4mol,
则c(HCl)=
=2.8mol/L,
故答案为:2.8.
则n(Al3+)=n(Al(OH)3)=0.2mol,m(Al)=0.2mol×27g/mol=5.4g;
故答案为:5.4;
(2)由图象可知,当加入NaOH700mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,则n(NaCl)=n(NaOH)=0.7L×2moL/L=1.4mol,
则c(HCl)=
| 1.4mol |
| 0.5L |
故答案为:2.8.
点评:本题以图象题的形式考查镁铝化合物性质、混合物的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意利用守恒思想进行计算.

练习册系列答案
相关题目
下列分离提纯物质的操作中,错误的是( )
| A、用过滤的方法除去食盐中的泥沙 |
| B、用分液的方法分离汽油和水 |
| C、用结晶的方法分离氯化钠和硝酸钾 |
| D、用加热的方法除去碳酸氢钠中混有的碘 |
下列鉴别方法可行的是( )
| A、用银氨溶液鉴别HCOOCH3和CH3CHO |
| B、用溴水鉴别乙烯和乙炔 |
| C、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D、用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如图,如图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期.下面关于该有机物的叙述不正确的是( )

| A、有机物化学式为C2HCl3 |
| B、可由乙炔和氯化氢加成得到 |
| C、该有机物难溶于水 |
| D、分子中所有原子在同一个平面内 |
下列冶炼金属的化学原理错误的是( )
A、2NaCl(熔融)
| ||||
B、MgO+H2
| ||||
C、2Al2O3(熔融)
| ||||
D、Fe2O3+3CO
|
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A、通常状况下,干燥的氯气能和Fe反应 |
| B、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
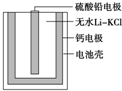 如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )
如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )| A、正极反应式:Ca+2Cl-+2e-═CaCl2 |
| B、放电过程中,Li+向负极移动 |
| C、每转移0.1mol电子,理论上生成20.7gPb |
| D、常温时,在正负极间接上电流表或检流计,指针不偏转 |