题目内容
下列反应原理或过程,不能用勒夏特列原理解释的是( )
| A、用N2和H2合成氨需采用高压 | B、由H2O2制氧气时使用MnO2催化剂 | C、醋酸溶液加水稀释醋酸的电离度增大 | D、温度升高水的电离程度增大 |
分析:勒夏特列原理是指在化学平衡发生改变的时候,化学平衡会向减少改变的方向移动,也就是阻止改变的方向移动,但不会回到原来,凡是存在可逆过程的反应,与平衡移动有关时,可用勒夏特列原理解释.
解答:解:A.合成氨工业:N2+3H2?2NH3 △H<0,正反应是气体体积减小反应,增大压强平衡向正反应方向移动,故采用较高的压强有利于氨的合成,能用平衡移动原理解释,故A不选;
B.催化剂只改变反应速率,不影响平衡移动,故B选;
C.醋酸为弱酸,加水促进电离,可用平衡移动原理解释,故C不选;
D.水的电离为吸热过程,加热促进电离,可用平衡移动原理解释,故D不选.
故选B.
B.催化剂只改变反应速率,不影响平衡移动,故B选;
C.醋酸为弱酸,加水促进电离,可用平衡移动原理解释,故C不选;
D.水的电离为吸热过程,加热促进电离,可用平衡移动原理解释,故D不选.
故选B.
点评:本题考查了化学平衡移动原理、化学平衡影响因素等,难度不大,注意使用平衡移动原理的前提必须是可逆过程,且与平衡移动有关.

练习册系列答案
相关题目
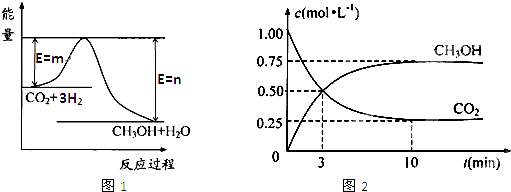
 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.