题目内容
【题目】用20mL 18.4molL﹣1 浓H2SO4与金属铜共热一段时间后,冷却,过滤,除去多余的铜,将滤液加水稀释到100mL,所得溶液中SO42﹣的物质的量浓度为3.18molL﹣1 , 则此时溶液中CuSO4的物质的量浓度为( )
A.0.50 molL﹣1
B.0.75 molL﹣1
C.1.00 molL﹣1
D.3.18 molL﹣1
【答案】A
【解析】解:20mL 18.4molL﹣1 浓H2SO4的物质的量为0.02L×18.4mol/L=0.368mol,n(SO42﹣)=0.368mol,
反应后n(SO42﹣)=0.1L×3.18molL﹣1=0.318mol,则减少的n(SO42﹣)=0.368mol﹣0.318mol=0.05mol,所以生成二氧化硫为0.05mol,
由Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑可知,n(CuSO4)=0.05mol,则c=
CuSO4+2H2O+SO2↑可知,n(CuSO4)=0.05mol,则c= ![]() =0.5mol/L,
=0.5mol/L,
故选A.

练习册系列答案
相关题目
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 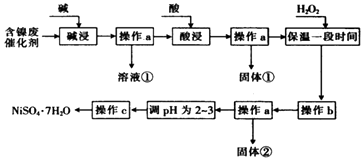
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .