题目内容
4.有关物质及其用途的描述,正确的是( )①Al2O3(作耐火坩埚)
②KAl(SO4)2•12H2O(作水的消毒剂)
③Fe2O3(作黄色油漆和涂料)
④NaHCO3(作食用碱)
⑤钠、钾、锶、钡等化合物(作烟花的焰色)
⑥Na2O2(作呼吸面具供氧剂)
| A. | ①④⑤⑥ | B. | ①②⑤⑥ | C. | ①③④⑤ | D. | 全部 |
分析 ①依据氧化铝熔点高性质解答;
②明矾溶于水,铝离子水解生成的具有吸附作用的氢氧化铝胶体;
③氧化铁为红棕色固体;
④碳酸氢钠不稳定,受热分解生成二氧化碳;
⑤依据焰色反应解答;
⑥过氧化钠与水、二氧化碳反应生成氧气.
解答 解:①Al2O3熔点高,耐高温,可以作耐火坩埚,故正确;
②明矾溶于水,铝离子水解生成的具有吸附作用的氢氧化铝胶体,可以净水,不具有杀菌消毒作用,故错误;
③氧化铁为红棕色固体;,用于制造红色油漆和涂料,故错误;
④碳酸氢钠不稳定,受热分解生成二氧化碳,常用作食品发酵剂,故正确;
⑤含不同金属元素的物质灼烧产生不同焰色,所以钠、钾、锶、钡等化合物(作烟花的焰色),故正确;
⑥过氧化钠与水、二氧化碳反应生成氧气,所以过氧化钠通常可用作供氧剂,故正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查物质的用途,熟悉相关物质的性质和用途是解题关键,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
15.下列事实不能用电化学原理解释的是( )
| A. | 可将地下输油钢管与外加直流电源的负极相连以保护钢管不受腐蚀 | |
| B. | 常温条件下,铝在空气中不易被腐蚀 | |
| C. | 镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更耐腐蚀 | |
| D. | 用锌与稀硫酸刮氢气时,往稀硫酸中滴少量硫酸铜溶液能加快反应速率 |
15.下列关于胶体的叙述中不正确的是( )
| A. | 只用肉眼就可以把胶体和溶液、浊液区别开来 | |
| B. | 向Fe(OH)3胶体中滴加少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子透过 | |
| D. | 胶粒的表面积较大,微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
19.下列电离方程式书写正确的是( )
| A. | H2S?2H++S2- | B. | H2S+H2O?H3O++HS- | ||
| C. | HCl?H++Cl- | D. | HClO═H++ClO- |
9.为了检验某FeCl2溶液是否变质,可选用的试剂是( )
| A. | K3[Fe(CN)6]溶液 | B. | 石蕊试液 | C. | KSCN溶液 | D. | 酸性KMnO4溶液 |
14.二氧化碳的回收利用是环保领域研究热点.
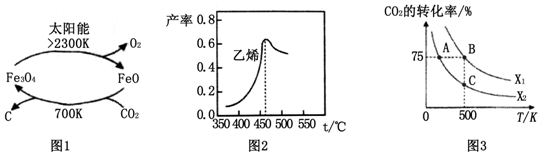
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是缩小容器体积.该温度下0~10min内H2的反应速率为0.06mol•L-1•min-1.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
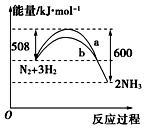 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ