题目内容
10.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )①金属性最强的是铯
②氧化性最强的是锂离子
③在自然界中均以化合态形式存在
④Li的密度最小,熔点最高
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+,Cs>Cs+.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
分析 ①依据同主族元素从上到下金属性依次增强解答;
②金属性越强,阳离子氧化性越弱;
③活泼金属在自然界中只能够以化合态存在;
④碱金属从上到下密度逐渐增大,熔点依次减弱;
⑤依据同主族元素从上到下金属性依次增强,结合钠、钾与水反应现象解答;
⑥锂只有Li2O;
⑦依据原子半径大小比较规律:电子层越多半径越大解答.
解答 解:①.Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以金属性最强的是铯,故①正确;
②.Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以金属性最弱的是锂,所以氧化性最强的是锂离子,故②正确;
③碱金属单质性质活泼,容易与空气中水、氧气反应,所以在自然界中均以化合态形式存在,故③正确;
④碱金属从上到下密度逐渐增大,熔点依次减弱,Li的密度最小,熔点最高,故④正确;
⑤Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以铯金属性强于钠和钾,与水反应剧烈程度强于钠和钾,故⑤正确;
⑥锂只有Li2O,不含有过氧化物,故⑥错误;
⑦电子层不同的,一般电子层越大半径越大,所以Rb+、K+、Na+,电子层依次减少,所以半径Rb+>K+>Na+;Cs、Cs+,电子层依次减少,所以半径Cs>Cs+,故⑦正确;
故选:D.
点评 本题考查了碱金属的性质,侧重考查学生对基础知识掌握熟练程度,掌握同主族元素性质的递变规律即可解答,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
8.往浅绿色的Fe(NO3)2溶液中,逐滴加入HNO3时,溶液的颜色变化应该是( )
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
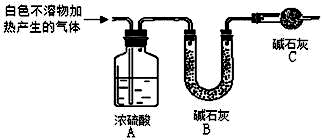
18.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如图实验探究反应原理并验证产物. 实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)提出假设:
猜测1:白色不溶物可能为Mg(OH)2.
猜测2:白色不溶物可能为MgCO3猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)定性实验:
④实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍.
(3)定量实验:
称取干燥、纯净的白色不溶物 14.2g,充分加热至不再产生气体为止,并使分解产生的气体全部进入如图装置中.实验后装置A 增重1.8g,装置B 增重4.4g.装置C 的作用是;若移除装置C 会导致x/y 的值偏大.
(填“偏大”、“偏小”或“不变”).?写出镁与饱和碳酸氢钠溶液反应的化学方程式3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.

(1)提出假设:
猜测1:白色不溶物可能为Mg(OH)2.
猜测2:白色不溶物可能为MgCO3猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
(3)定量实验:
称取干燥、纯净的白色不溶物 14.2g,充分加热至不再产生气体为止,并使分解产生的气体全部进入如图装置中.实验后装置A 增重1.8g,装置B 增重4.4g.装置C 的作用是;若移除装置C 会导致x/y 的值偏大.
(填“偏大”、“偏小”或“不变”).?写出镁与饱和碳酸氢钠溶液反应的化学方程式3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
5.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA | |
| D. | 14g乙烯和丙烯混合气体中的氢原子数为2NA |
 .
.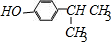 .
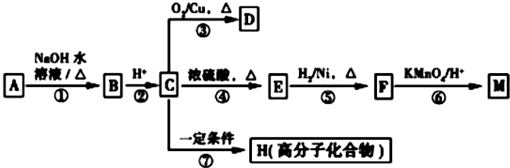
.
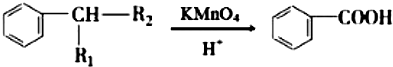 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)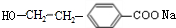 .
.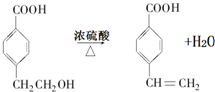 .
.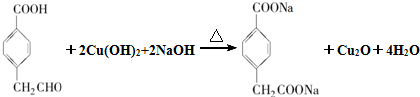 .
.