题目内容
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)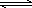 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)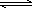 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”).
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
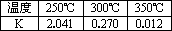
由表中数据判断ΔH1________0(填“>”、“=”或“<”).
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________.
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置.
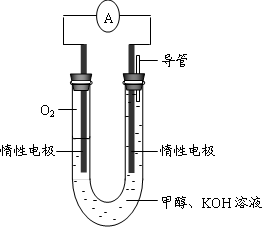
①该电池正极的电极反应为________.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为________.
答案:
解析:
解析:
|
(1)①Ⅰ ②< ③80% 250℃ (2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=﹣442.8 kJ∕mol (3)①O2+2H2O+4e-=4OH- ②2CH3OH+3O2+4OH-=2CO32-+6H2O |

练习册系列答案
相关题目
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景. (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
