题目内容
2.下列说法中,不正确的是( )| A. | 短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 | |
| B. | 第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+ | |
| C. | 日本核电站释放出的131I、132I和133I属于同素异形体 | |
| D. | 相同条件下,测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |
分析 A.短周期元素中,最外层电子数是其电子层数两倍的元素有He、C、S;
B.电子层越多,离子半径越大,具有相同电子排布的离子原子序数大的离子半径小;
C.131I、132I和133I为质子数相同,中子数不同的原子;
D.测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可知酸性为硫酸>碳酸,以此比较非金属性.
解答 解:A.短周期元素中,最外层电子数是其电子层数两倍的元素有He、C、S,共3种,故A正确;
B.电子层越多,离子半径越大,可知S2-、Cl-离子半径大于Na+、Mg2+、Al3+,具有相同电子排布的离子原子序数大的离子半径小,则离子半径为S2->Cl->Na+>Mg2+>Al3+,故B正确;
C.131I、132I和133I为质子数相同,中子数不同的原子,则互为同位素,故C错误;
D.测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可知酸性为硫酸>碳酸,可知非金属性S>C,故D正确;
故选C.
点评 本题考查元素性质,为高频考点,侧重考查学生知识迁移能力,把握元素的位置、性质及元素周期律、相关概念的应用等为解答的关键,综合性较强,题目难度不大.

练习册系列答案
相关题目
12.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
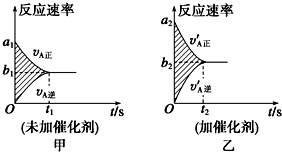
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
①30min时,反应到达平衡状态了吗?是(填“是”或“否”)简述理由从20min到30min时各物质的浓度没有发生改变
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
13.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素的中子数为8可测定文物年代,这种同位素的符号是614C(用AZX符号表示);元素Z的离子结构示意图为 .
.
(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
10.下列各组物质性质的比较中,正确的是( )
| A. | 热稳定性:NH3<PH3<H2O | |
| B. | P元素最高价氧化物对应的水化物酸性比Cl的强 | |
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 元素非金属性:O>F |
7.下列各组离子,一定能在指定环境中大量共存的是( )
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存 | |
| C. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42?、C1?、HCO3? |
14.将NaCl溶液中与下列试剂混合,会出现沉淀的是( )
| A. | 2mol/LAgNO3溶液 | B. | 2mol/LNaOH溶液 | C. | 2mol/LMgSO4溶液 | D. | Fe(OH)3胶体 |
11.25℃时,0.1mol?L-1的下列溶液pH的由大到小的顺序为NaCN>NaClO>CH3COONa,下列说法正确的是( )
| A. | 酸性由强到弱的顺序为HCN>HClO>CH3COOH | |
| B. | 0.1mol?L-1 NaClO溶液的碱性一定比0.1 mol?L-1 CH3COONa强 | |
| C. | 等物质的量浓度的CH3COONa溶液和醋酸溶液都促进了水的电离 | |
| D. | a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合,溶液中c(Na+)=c(CN-),则a=b |
12.为了除去CO2气体中的HCl气体可通过装有下列哪种物质的洗气瓶( )
| A. | NaOH溶液 | B. | 饱和Na2CO3溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和氯化钠溶液 |
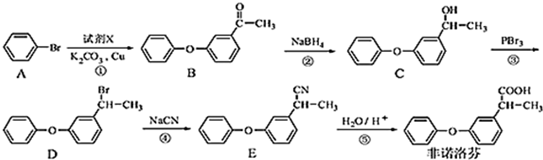
 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.