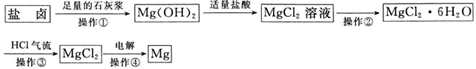
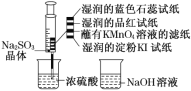
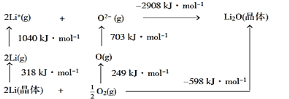
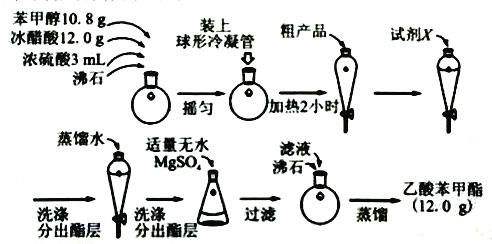
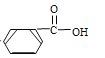
题目内容
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
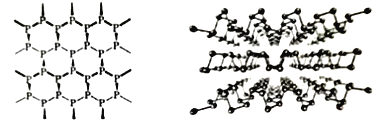
(1)黑磷是新型材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上可以看出单层磷烯并非平面结构,但其导电性却优于石墨烯的原因是________________。
(2)四(三苯基膦)钯分子结构如下图:
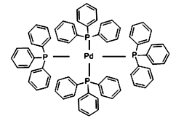
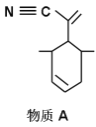
该物质可用于上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________;
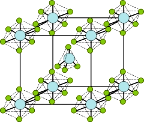
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子.(该晶体的晶胞如图所示).熔体中P-Cl的键长只有198 nm和206 nm两种,写这两种离子的化学式为______________________;正四面体形阳离子中键角_____ PCl3的键角(填> 或<或=),原因是______________________________________.
(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________________。
【答案】范德华力 石墨烯中1个碳原子和周围3个碳原子结合后还剩1个价电子 ,单层磷烯同层磷原子中1个磷原子和周围3个磷原子结合后还剩2个价电子 sp、sp2、sp3 PCl4+和PCl6- > PCl3中P原子有一对孤电子对,PCl4+中P没有,孤电子对对成键电子的排斥力大于成键电子对间的排斥力 PBr5=PBr4++Br-
【解析】
(1)黑磷具有类似石墨一样的片层结构,石墨层间是范德华力连接,从结构上看,单层磷烯导电性优于石墨烯,从成键原子的电子结构分析;
(2)根据碳原子的成键情况要以判断碳原子的杂化方式,物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角;
(4)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,结合产物中只存在一种P-Br键长书写.
(1)黑磷具有类似石墨一样的片层结构,石墨层间是范德华力连接,
从结构上看,单层磷烯导电性优于石墨烯,从成键原子的电子结构分析,石墨烯同层碳原子中,1个碳原子和周围3个碳原子结合后,还剩1个价电子,单层磷烯同层磷原子中,1个磷原子和周围3个磷原子结合后,还剩2个价电子,后者剩余电子多,导电性增强。
(2)物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,PCl3中价层电子对个数=σ键个数+孤电子对个数=3+(5-3×1)/2=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子(PCl4+)中键角大于PCl3的键角。
(4)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴、阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-。