题目内容
将一滴(0.05ml)0.1mol.L-1 的盐酸滴入50ml水中,所得溶液的pH 约为 .
考点:pH的简单计算
专题:
分析:根据稀释定律计算稀释后HCl的物质的量浓度,进而确定c(H+),再根据pH=-lgc(H+)计算;
解答:
解:根据稀释定律,稀释恰好HCl的物质的量相等,故稀释后HCl的物质的量浓度为
=1×10-4mol/L,故稀释后溶液c(H+)=1×10-4mol/L,稀释后溶液pH=-lg 1×10-4=4,故答案为:4.
| 0.05mL×0.1mol/L |
| 50mL |
点评:本题考查溶液pH的计算,难度不大,注意溶液稀释接近中性时应考虑水电离的氢离子.

练习册系列答案
相关题目
下列示意图与对应的反应情况符合的是( )
A、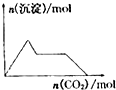 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
B、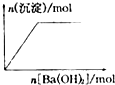 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
C、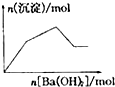 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
D、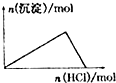 向NaAlO2溶液中逐滴加入盐酸至过量 |
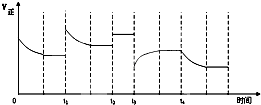 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反应过程中,正反应速率的变化如如图,下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反应过程中,正反应速率的变化如如图,下列说法正确的是( )| A、t1时增大了压强 |
| B、t2时同倍数增加N2、H2的物质的量 |
| C、t3时降低了温度 |
| D、t4时增大了c(NH3) |
某同学通过系列实验,探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A、将铜粉和硫粉混合均匀并加热以制取CuS |
| B、将Cu片放入过量浓硫酸中,一段时间后加水以观察CuSO4溶液的颜色 |
| C、向CuSO4溶液中加入NaOH溶液,过滤洗涤并收集沉淀,加热以制取CuO |
| D、设计Cu-Al-浓硝酸原电池,以证明金属活动性:Cu<Al |
氯气与2,3-二甲基丁烷发生取代反应时,生成的一氯代物有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
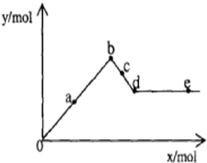 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |