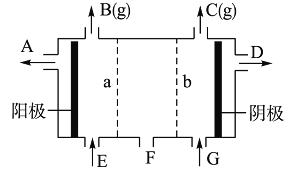
��Ŀ����
����Ŀ������һ�ݺ���FeCl3��FeCl2�������Ϊ�ⶨ���ɷֵĺ���������������ʵ�飺
ʵ��1���� ��ȡһ����������Ʒ������Ʒ�ܽ⣻
�� ���ܽ�����Һ�м���������AgNO3��Һ������������
�� ���������ˡ�ϴ�ӡ�����õ���ɫ����17.22 g��
ʵ��2���� ��ȡ��ʵ��1����ͬ��������Ʒ������Ʒ�ܽ⣻
�� ���ܽ�����Һ��ͨ��������Cl2��
�� ������������Һ�м���������NaOH��Һ���õ����ɫ������
�� ���������ˡ�ϴ�Ӻ������գ����������ټ��٣��õ���������4g��
�ش��������⣺
��1���ܽ���������õ��IJ���������___________________��
��2��ʵ���ұ���FeCl2��Һʱͨ���������м��������Լ�_____________��_____________��
��3��ʵ��2ͨ������Cl2��Ŀ����________ ��
�漰�Ļ�ѧ��Ӧ�����ӷ���ʽ��______ _��
��4����μ����ܽ���Ʒ�к���Fe2+ ��
��5��ͨ��ʵ���������ݣ����������Ʒ��FeCl3��FeCl2�����ʵ���֮��Ϊ_________��
���𰸡���1���ձ���������
��2��������ϡ����
��3����Fe2+ȫ��ת��ΪFe3+��2Fe2++Cl2=2Fe3++2Cl��
��4��ȡ������Ʒ�ܽ�Һ���Թ��У��μ������軯���Լ��������Ը��������Һ������������ɫ��������Һ��ɫ����֤��������������
��5��2:3
��������
�����������1���ܽ�ʱ����ѹ�����������ձ��У����ò��������裬�Դٽ��ܽ����ʣ������õ�������Ϊ���ձ�����������
��2��Fe2+�ױ������е�����������Fe3+��ʹ��Һ������Ϊ�˷�ֹFe2+��������FeCl2��Һ�������������������Fe2+��ˮ�⣬FeCl2+2H2O![]() Fe(OH)2+2HCl��Ϊ�˷�ֹFeCl2ˮ�⣬FeCl2��Һ�������ϡ���ᡣ
Fe(OH)2+2HCl��Ϊ�˷�ֹFeCl2ˮ�⣬FeCl2��Һ�������ϡ���ᡣ
��3�����ܽ�����Һ��ͨ��������Cl2��Ŀ������Cl2��Fe2+ȫ����������Fe3+�������ķ�ӦΪ��
Cl2+2FeCl2=2FeCl3�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
��4��������Ʒ�ܽ�Һ���Ƿ���Fe2+�ķ�����ȡ������Ʒ�ܽ�Һ���Թ��У��μ������軯���Լ�����������ɫ������֤����Ʒ�ܽ�Һ�к����������ӣ�������Ʒ�ܽ�Һ�еμ����Ը��������Һ������Һ��ɫ��֤����Ʒ�ܽ�Һ�к����������ӡ�
��5����FeCl3��FeCl2�����ʵ����ֱ�Ϊamol��bmol��
������Ԫ���غ���У�3amol+2bmol=![]() =0.12mol��
=0.12mol��
������Ԫ���غ���У�amol+bmol=![]() ��2=0.05mol
��2=0.05mol
���a=0.02��b=0.03��������Ʒ��FeCl3��FeCl2�����ʵ���֮��Ϊ2:3��