题目内容
【题目】水的离子积常数Kw与温度T(℃)的关系如图D3-5所示:
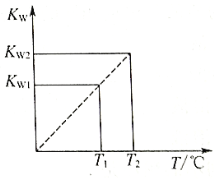
(1)若T1=25℃,则Kw1=_____________;若T2=100℃时,Kw2=10-12,则此时0.05mol/L的Ba(OH)2溶液的pH=_____________。
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有_______________________________________________。
溶液中各离子的物质的量浓度由大到小的顺序为__________________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为_____________。
【答案】![]() 11
11 ![]()
![]() ,
,![]() 1:9
1:9
【解析】
(1) KW只与温度有关,根据图像可知 KW1< KW2, 所以T1< T2,根据KW= c(OH-)![]() c(H+)进行计算;
c(H+)进行计算;
(2)0.1mol/L的NaA溶液pH>7,说明HA为弱酸,溶液中存在的平衡有H2O![]() H++OH- 、 A-+H2O
H++OH- 、 A-+H2O![]() HA+OH-;据此进行分析;
HA+OH-;据此进行分析;
(3)根据酸碱中和,碱过量进行计算:c(OH-)= [c(OH-)×V1- c(H+)×V2]/(V1+V2)进行计算;
(1)25℃时,c(H+)=c(OH-)=10-7mol/L,KW1=10-11;若T2=100℃时,Kw2=10-12,c(OH-)=0.05×2=0.10mol/L,c(H+)=10-12/0.1=10-11, pH=11;综上所述,本题答案是:1×10-11,11。
(2)0.1mol/L的NaA溶液pH>7,说明HA为弱酸,溶液中存在的平衡有H2O![]() H++OH- 、 A-+H2O
H++OH- 、 A-+H2O![]() HA+OH-;离子浓度的大小顺序为c(Na+)> c(A-)> c(OH-)>c(H+);综上所述,本题答案是:H2O
HA+OH-;离子浓度的大小顺序为c(Na+)> c(A-)> c(OH-)>c(H+);综上所述,本题答案是:H2O![]() H++OH- 、A-+H2O
H++OH- 、A-+H2O![]() HA+OH-;c(Na+)> c(A-)> c(OH-)>c(H+)。
HA+OH-;c(Na+)> c(A-)> c(OH-)>c(H+)。
(3)V(NaOH)=xmL,V(H2SO4)=ymL,则有c(OH-)=(10-3x-10-4y)/(x+y)=10-5,解得x:y=1:9。综上所述,本题答案是:1:9。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】(2011·惠州市调研)一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质 | AgCl | AgI | Ag2S |
颜色 | 白 | 黄 | 黑 |
Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同