题目内容
8.为测定某混合溶液中CuSO4和Na2SO4的物质的量浓度,取两份20.00mL溶液,第一份加入过量BaCl2溶液,产生6.99g沉淀;第二份加入过量的NaOH溶液,产生0.98g沉淀,求CuSO4和Na2SO4的物质的量浓度(写出计算过程).分析 氯化钡与硫酸根离子反应生成硫酸钡沉淀,6.99g为硫酸钡沉淀;氢氧化钠与铜离子反应生成氢氧化铜沉淀,0.98g沉淀为氢氧化铜,根据n=$\frac{m}{M}$分别计算出硫酸钡、氢氧化铜的物质的量,然后根据质量守恒定律计算出硫酸铜、硫酸钠的物质的量,再根据c=$\frac{n}{V}$计算出CuSO4和Na2SO4的物质的量浓度.
解答 解:第一份加入过量BaCl2溶液,产生6.99g沉淀,该沉淀为硫酸钡,则BaSO4的物质的量为:$\frac{6.99g}{233g/mol}$=0.03mol,故原混合物中n(SO42-)=n(BaSO4)=0.03mol;
第二份加入过量的NaOH溶液,产生0.98g沉淀,该沉淀为Cu(OH)2,0.98g氢氧化铜沉淀的物质的量为:n[Cu(OH)2]=$\frac{0.98g}{98g/mol}$=0.01mol,则硫酸铜的物质的量为0.01mol,硫酸铜的物质的量浓度为:c(CuSO4)=$\frac{0.01mol}{0.02L}$=0.5mol/L;
根据硫酸根了守恒可知,原20mL溶液中含有硫酸钠的物质的量为:0.03mol-0.01mol=0.02mol,Na2SO4的物质的量浓度为:c(Na2SO4)=$\frac{0.02mol}{0.02L}$=1mol/L,
答:CuSO4和Na2SO4的物质的量浓度分别为0.5mol/L、1mol/L.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
10.下列实验操作能达到预期目的是( )
| A. | 蒸发AlCl3溶液获得AlCl3固体 | |
| B. | 将Fe2(SO4)3溶液与NaOH溶液混合制备Fe(OH)3胶体 | |
| C. | 测定Na2CO3溶液、Na2SO3溶液的pH,比较C、S的非金属性强弱 | |
| D. | 以粗铜作阳极,纯铜片作阴极,CuCl2溶液作电解质溶液,电解精炼铜 |
11.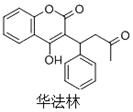 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )| A. | 分子中2个苯环一定处于同一平面 | |
| B. | 1mol华法林最多能与2mol NaOH反应 | |
| C. | 在一定条件下,华法林可与HCHO发生缩聚反应 | |
| D. | 在NaOH水溶液中加热,华法林可发生消去反应 |
3.下列属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | 铁片投入稀硫酸中 | ||
| C. | NH4HCO3受热分解 | D. | 向Na2SO4溶液滴加KCl溶液 |
13.某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色.为确定该溶液的组成,还需检验的离子是( )
| A. | Ba2+ | B. | SO42- | C. | K+ | D. | NH4+ |
18.将NaAlO2溶液中加入下列物质,不可能产生白色沉淀的是( )
| A. | HCl | B. | NaHSO4 | C. | CO2 | D. | Na2CO3 |
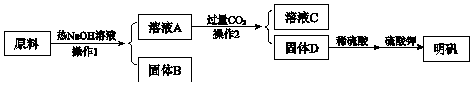
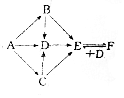 有A、B、C、D、E、F六种物质,其中A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体,其他均为白色固体,它们之间的相互转化关系如图所示(反应条件及其他产物均已略去).
有A、B、C、D、E、F六种物质,其中A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体,其他均为白色固体,它们之间的相互转化关系如图所示(反应条件及其他产物均已略去).