题目内容
| |||||||||||||||||||||||||
解析:
(1) |
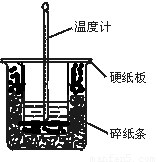
本题考查对中和热的有关问题,对中和热概念的理解,应着重抓住三个点“稀”、“强”、“1 mol”.A应注意判断,虽然H2SO4是二元酸,但是发生反应时,NaOH不足,所以仍是只生成1 mol H2O,所测即是中和热;B中忽略了“稀”;C中忽视了“强”;D中忽视了“稀”,同时也有可能有其他的离子键生成,如有BaSO4生成. |
(2) |
答案:环形搅拌器,温度计,大烧杯,小烧杯,量筒,暖瓶(或保温瓶) 思路与技巧:本题是对中和热测定实验理论上的深入理解与思考,注意审题——测定所需的玻璃容器;另外题目中的信息对做题有一定的提示,指出中和热测定实验的关键是量热器要尽量做到绝热,这也是对信息利用能力的考查,根据此信息,考虑生活中可以保证绝热的仪器,就是保温瓶. |
(3) |
不影响生成1 mol H2O,不影响“稀”,但能够加速反应,且使反应进行完全,使测量的误差减小 |
提示:
|
抓住对实验测定机理的理解,与生活相联系,将化学与生活结合,是一种实际应用能力的考查. |

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案