题目内容
某同学测得物质的量浓度均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,得出下列关系式,你认为其中不正确的是( )
分析:物质的量浓度均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,则醋酸的电离大于醋酸钠中醋酸根离子的水解,以此来解答.
解答:解:A.醋酸的电离大于醋酸钠中醋酸根离子的水解,即c(CH3COO-)略大于0.01mol/L,c(CH3COOH)略小于0.01mol/L,所以c(CH3COO-)>c(CH3COOH),故A正确;
B.均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,醋酸的电离大于醋酸钠中醋酸根离子的水解,溶液显酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.c(Na+)=0.01mol/L,而c(CH3COO-)略大于0.01mol/L,故C错误;
D.根据物料守恒可知,均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液中c(CH3COOH)+c(CH3COO-)=0.02mol?L-1,故D正确;
故选C.
B.均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,醋酸的电离大于醋酸钠中醋酸根离子的水解,溶液显酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.c(Na+)=0.01mol/L,而c(CH3COO-)略大于0.01mol/L,故C错误;
D.根据物料守恒可知,均为0.01mol?L -1的CH3COOH和CH3COONa的混合溶液中c(CH3COOH)+c(CH3COO-)=0.02mol?L-1,故D正确;
故选C.
点评:本题考查溶液中离子浓度大小的比较,明确溶液中酸的电离大于盐类的水解是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
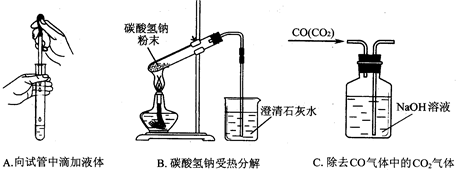


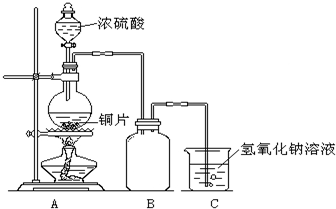 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验: