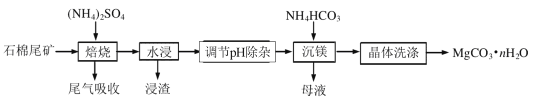
题目内容
【题目】下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
【答案】D
【解析】
A.酸或碱抑制水的电离,含弱离子的盐促进水的电离,NaOH是强碱,Na2CO3是强碱弱酸盐,则NaOH抑制水的电离,Na2CO3促进水的电离,所以两者水解程度不同,故A项错误;B项,醋酸为弱酸,其它条件不变,稀释醋酸溶液,c(H+)减小,c(OH-)增大,所以c(OH-)/c(H+)增大,故B错误; C.NaOH溶液显碱性,抑制水的电离,其它条件不变,稀释氢氧化钠溶液,其对水电离的抑制程度将降低,所以水的电离程度增大,故C项错误。D.温度升高,水的电离程度增大,c(OH-)和c(H+)增大,所以KW= c(OH-)![]() c(H+)增大,故D项正确;答案为D。
c(H+)增大,故D项正确;答案为D。

练习册系列答案
相关题目
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105