题目内容
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
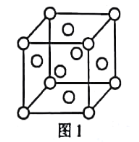
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
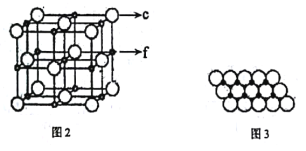
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
【答案】第四周期第ⅣB族 面心立方最密 NO3-、CO32- 1:1 V、Co ![]() NiO
NiO ![]() g
g
【解析】
元素e的基态原子的3d轨道上有2个电子,其基态原子的核外电子排布应为1s22s22p63s23p63d24s2,为Ti元素;基态f原子M层有2个未成对电子且位于第Ⅷ族,其基态原子的核外电子排布应为1s22s22p63s23p63d84s2,为Ni元素;c与d位于同一主族,其原子序数小于Ti,则a、b、c、d均为前20元素,且a、b、c为短周期元素,a、c的基态原子中均有2个未成对电子,则其p轨道的电子排布为np2或np4,为第ⅣA族或ⅥA族元素,又因为c、d同主族,且d为前20号元素,所以c只能为第二周期元素,则a、c的p轨道电子排布为2p2和2p4,即a为C,c为O,则d为S,b位于a、c之间,则b为N。
(1)e为Ti元素,为22号元素,位于元素周期表第四周期第ⅣB族;f为Ni元素,据图可知该晶胞堆积为面心立方最密堆积;
(2)a为C,b为N,c为O,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有NO3-、CO32-;一个氢原子与一个a原子、一个b原子组成的分子为HCN,中心C原子为sp杂化,与N原子形成三键,其中有1个σ键和2个π键,与H原子形成1个σ键,所以分子中σ键和π键的数目之比为1:1;
(3)b为N,其未成对电子为3对,前四周期基态原子未成对电子数与其相同的元素的外围电子排布应为3s23p3或3d34s2或3d84s2,分别为P、V、Co,其中P与N元素同主族;
(4)d为S,其低价酸性氧化物为SO2,在SO2分子中,硫原子以两个sp2杂化轨道分别与两个氧原子形成σ键,而另一个sp2杂化轨道上则保留1对孤对电子,硫原子的未参与杂化的p轨道上的2个电子与两个氧原子的未成对p电子形成三中心、四电子的离域大π键,表示为![]() ;
;
(5)①c为O,f为Ni,根据均摊法可知该晶胞中O原子个数为![]() =4,Ni原子个数为
=4,Ni原子个数为![]() =4,所以晶体的化学式为NiO;
=4,所以晶体的化学式为NiO;
②取平面NiO基本结构单元为 ,重复单元呈菱形, O离子之间最短核间距为a pm,则结构单元的面积为:(a×a×sin60°)m2=
,重复单元呈菱形, O离子之间最短核间距为a pm,则结构单元的面积为:(a×a×sin60°)m2=![]() a2×10-24m2,每个重复单元包含1个O原子和1个Ni原子,其质量=
a2×10-24m2,每个重复单元包含1个O原子和1个Ni原子,其质量=![]() g,则1m2上该晶体的质量=
g,则1m2上该晶体的质量=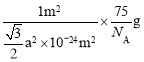 =
=![]() g。
g。