题目内容
 已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图.
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图.(1)若甲和X均为第二周期元素的常见非金属单质,且乙为直线形分子,则乙的结构式为
O=C=O
O=C=O
.(2)若甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质.写出乙和X反应的离子方程式:
HSO3-+OH-=SO32-+H2O
HSO3-+OH-=SO32-+H2O
;(2)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,写出甲和丙反应的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.分析:(1)若甲和X均为第二周期元素的常见非金属单质,且乙为直线形分子,则甲为C,X为C,则乙为CO2;
(2)甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质,甲为SO2,X为NaOH,乙为NaHSO3,丙为Na2SO3;
(3)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,则甲为AlCl3,X为NaOH,乙为Al(OH)3,丙为NaAlO2,以此来解答.
(2)甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质,甲为SO2,X为NaOH,乙为NaHSO3,丙为Na2SO3;
(3)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,则甲为AlCl3,X为NaOH,乙为Al(OH)3,丙为NaAlO2,以此来解答.
解答:解:(1)若甲和X均为第二周期元素的常见非金属单质,且乙为直线形分子,则甲为C,X为C,则乙为CO2,其结构式为O=C=O,故答案为:O=C=O;
(2)甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质,甲为SO2,X为NaOH,乙为NaHSO3,丙为Na2SO3,则乙和X反应的离子方程式为HSO3-+OH-=SO32-+H2O,故答案为:HSO3-+OH-=SO32-+H2O;
(3)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,则甲为AlCl3,X为NaOH,乙为Al(OH)3,丙为NaAlO2,甲和丙反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
(2)甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质,甲为SO2,X为NaOH,乙为NaHSO3,丙为Na2SO3,则乙和X反应的离子方程式为HSO3-+OH-=SO32-+H2O,故答案为:HSO3-+OH-=SO32-+H2O;
(3)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,则甲为AlCl3,X为NaOH,乙为Al(OH)3,丙为NaAlO2,甲和丙反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评:本题考查了无机物的推断,注意物质转化关系的特征转变、物质性质的应用,把握转化关系分析物质即可解答,题目难度较大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图.则甲和X(要求甲和X互换后也能符合要求)可能是 ( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图.则甲和X(要求甲和X互换后也能符合要求)可能是 ( )①Na2CO3溶液和稀盐酸
②Cl2和Fe
③C和O2
④SO2和NaOH溶液
⑤AlCl3溶液和NaOH溶液.
| A、②③④均可以 | B、③④⑤均可以 | C、①③⑤均可以 | D、①③④均可以 | E、①③④⑤均可以 |
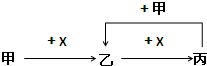 已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )| A、甲为C,X为O2 | B、甲为SO2,X为NaOH溶液 | C、甲为Fe,X为Cl2 | D、甲为AlCl3,X为NaOH溶液 |
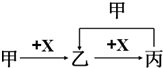 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )| A、甲为C,X为O2 | B、甲为Fe,X为Cl2 | C、甲为SO2,X为NaOH溶液 | D、甲为Cl2,X为Fe |
 已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )