题目内容
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W
【答案】C
【解析】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,在元素周期表中,Z与Y、W均相邻,Y、Z、W三种元素的原子最外层电子数之和为17,若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: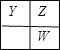 、
、![]() ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x=
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x=![]() ,不合理,且X、Y、W分别位于不同周期,则X为H元素;A.H、N、O三元素可以形成硝酸,属于共价化合物,可以形成硝酸铵,属于离子化合物,故A正确;B.Y和Z位于相同周期,原子半径从左到右原子半径逐渐减小,应为r(Y)>r(Z),故B正确;C.H与N、O元素之间形成的核外电子总数为10的微粒有NH3、NH4+、OH-、H2O、H3O+等,故C错误;D.H2O、H2S都形成分子晶体,但H2O分子之间存在氢键,其沸点比H2S高,氧的非金属性比硫强,则H2O的稳定性比H2S强,故D正确;故选C。
,不合理,且X、Y、W分别位于不同周期,则X为H元素;A.H、N、O三元素可以形成硝酸,属于共价化合物,可以形成硝酸铵,属于离子化合物,故A正确;B.Y和Z位于相同周期,原子半径从左到右原子半径逐渐减小,应为r(Y)>r(Z),故B正确;C.H与N、O元素之间形成的核外电子总数为10的微粒有NH3、NH4+、OH-、H2O、H3O+等,故C错误;D.H2O、H2S都形成分子晶体,但H2O分子之间存在氢键,其沸点比H2S高,氧的非金属性比硫强,则H2O的稳定性比H2S强,故D正确;故选C。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍。元素M与Z同周期,且原子半径是同周期中最大的。元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙。
X | Y | |
Z | W |
请按要求回答下列问题:
(1)X的单质的电子式:_________;W最高价氧化物的水化物的化学式:________________。
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为(填离子符号)__________;写一个能说明元素W比元素Z的非金属性强的化学方程式:____________________。
(3)甲变为乙的化学方程式为_______________________。
(4)常温下,当用200mL 1mol·L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为___________;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为___________________________。
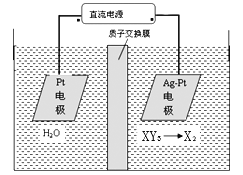
(5) 工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为_______________。